利用高压电势(HELP)设备产生电场(EF)的医疗是日本常用的一种替代疗法,但其分子机制尚不清楚。健康人类受试者暴露于HELP的单一刺激下15 min,之后在0、15和45 min时间点使用酶联免疫吸附试验(ELISA)检测几种肽激素和细胞因子的血浆浓度。β内啡肽,gydF4y2BaαgydF4y2Ba-黑素细胞刺激激素(α-MSH)、胰高血糖素样肽-1 (GLP-1)、白介素(IL)-4、IL-12和干扰素-γ (IFN- γ)水平显著上调。在这些条件下,HELP暴露对促肾上腺皮质激素释放激素(CRH)、促肾上腺皮质激素(ACTH)、IL-6或IL-10水平没有影响。因为HELP暴露会引起gydF4y2Ba独联体gydF4y2Ba-8,11,14-二十碳三烯酸(二homo- γ -亚麻酸;研究了DGLA对β-内啡肽分泌的影响。在人表皮角质形成细胞中,DGLA能显著诱导β -内啡肽的分泌,但对α-MSH无明显诱导作用。dgla诱导的β-内啡肽分泌对G蛋白偶联受体(GPR) 40拮抗剂GW1100敏感。我们的发现为EF治疗引起的疼痛控制和防御感染的分子机制提供了新的见解。gydF4y2Ba
疼痛,高压电势,电场疗法,β-内啡肽,白细胞介素-12gydF4y2Ba
ACTH:促肾上腺皮质激素;α-MSH: alpha-melanocyte-stimulating激素;促肾上腺皮质激素释放激素CRH:;DGLA:二homo -亚麻酸;DHA:gydF4y2Ba独联体gydF4y2Ba4、7、10、13、16日19-docosahexaenoic酸;英孚:电场;环境影响评价:酶免疫分析法;ELISA:酶联免疫吸附法;EMF:电磁场;GLP-1:胰高血糖素样肽1;GPR: G蛋白偶联受体;(GW1100:1) - 4-ethoxycarbonylphenyl 2 - (4-fluorobenzylthio) 5 - (2-ethoxy-5-pyrimidinylmethyl) 4-pyrimidinone;帮助:高压电势;IL:白介素; IFN: interferon; NK: natural killer; OEA: oleoylethanolamide; POMC: proopiomelanocortin; TRPV1: transient receptor potential vanilloid 1
日本厚生劳动省(Ministry of Health, Labour and Welfare)批准了一种将人体暴露于高压电势(HELP)中的治疗装置[1-3]。高压电场(EF)疗法被报道是治疗肩僵、便秘、失眠、头痛的有效方法[1-9]。虽然EF治疗的机制很大程度上还不清楚,但以前使用非靶向血浆代谢组学寻找EF暴露诱导的生物标志物的尝试,导致检测内源性信号分子油酰乙醇酰胺(OEA),一种推测的多种蛋白质激动剂,包括过氧化物酶体增殖物激活受体-α (PPAR-α)、G蛋白偶联受体(GPR) 119、GPR55和瞬时受体电位香草醛1 (TRPV1)[10]。内源性肽激素被认为是可能代表症状和治疗靶蛋白之间的界面的候选分子。劳弗最近的一项研究gydF4y2Ba等gydF4y2Ba.报道OEA可增加肠道内分泌l -细胞[11]中GLP-1的分泌。劳弗的观察gydF4y2Ba等gydF4y2Ba.引导我们研究HELP暴露对肽激素[11]水平的影响。在本研究中,我们使用酶联免疫吸附法(ELISA)研究了健康受试者暴露于单一HELP刺激前和不同时间(0,15或45分钟)后的血浆样本中几种肽激素的水平。在这里,我们报道了血浆β-内啡肽水平可以通过HELP暴露上调。为了阐明导致β-内啡肽水平变化的机制,我们检测了DGLA在人角质形成细胞中的作用,表明它能诱导β-内啡肽的分泌。gydF4y2Ba
EF暴露
用于EF暴露的系统已在前面描述过[9-10]。EF系统配备了一个变压器、一个座椅和两个绝缘体覆盖的电极;一个电极放置在受试者脚所在的地板上,另一个电极放置在受试者头部上方。由HELP仪器(Healthtron PRO-18T或hesr - a30;日本东京白州健康科学研究所(Hakuju Institute for Health Science Co., Ltd., Japan, Tokyo)是通过在18千伏或30千伏转换50赫兹交流电而统一创建的。这种供人使用的系统的安全性是由日本政府在1963年确定的。gydF4y2Ba
主题
10名健康成人[5男5女;平均年龄42.4±2.8岁;平均体重指数(BMI) 23.6±1.0 kg/mgydF4y2Ba2gydF4y2Ba]参与实验一(暴露条件:18 kV, 15 min)。10名健康成人(6男4女;平均年龄45.9±2.9岁;平均BMI 22.9±1.0 kg/mgydF4y2Ba2gydF4y2Ba)参与实验二(暴露条件:30 kV, 15分钟)。所有的实验都在早上进行,所有的参与者在收到关于研究的口头和书面信息后签署了一份知情同意书。所有实验都是按照《赫尔辛基宣言》进行的,研究方案得到了日本东京白菊健康科学研究所人类伦理委员会的批准。gydF4y2Ba
等离子体的准备
用乙二胺四乙酸(VP-NA070K;Terumo株式会社,东京,日本),并立即在800 ×离心gydF4y2BaggydF4y2Ba用离心机从其他细胞物质中分离血浆5分钟。随后,血浆被转移到一个新鲜的eppendorf管中并在-80℃下储存gydF4y2Ba°gydF4y2Ba直到处理C。gydF4y2Ba
ELISA /环境影响评价分析
等离子体水平的β内啡肽,α-MSH, CRH, ACTH, GLP-1, il - 4、il - 6、il - 10、il - 12,和干扰素-γ测量使用人类β内啡肽,α-MSH,和GLP-1酶联免疫试剂盒从Cusabio生物科技(湖北武汉,中国),人类CRH环评装备,一个ACTH的酶联免疫试剂盒Cloud-Clone(休斯顿,德克萨斯州),或人类il - 4、il - 6、il - 10、il - 12,IFN-γ酶联免疫吸附测定试剂盒来自R&D systems (Minneapolis, MN)。gydF4y2Ba
分子建模与对接研究
GPR40与激动剂TAK-875 (4PHU;Protein Data Bank Japan)用于分子对接研究。这项DGLA与GPR40结合的对接研究使用Sybyl-X2.0软件包(Tripos International, St. Louis, MO)中包含的Surflex-Dock程序进行[10,12]。对接实验进行了5次,获得了3个对接位置。gydF4y2Ba
人表皮角质形成细胞分泌β-内啡肽
人表皮角质形成细胞(Lonza, Basel, Switzerland)培养在kmb - gold角质形成细胞基础培养基(Lonza)中添加2 mM l -谷氨酰胺和10%胎牛血清(Lonza)。简而言之,是1.3 x 10gydF4y2Ba5gydF4y2Ba细胞接种于12孔多壁板的孔中。24 h后换为新鲜无血清培养基,加入GW1100。在GW1100培养液中待30 min后加入DGLA。24 h后,保存培养基用于β-内啡肽酶联免疫吸附测定。gydF4y2Ba
化学物质
独联体gydF4y2Ba8、11 14-eicosatrienoic酸(DGLA),gydF4y2Ba独联体gydF4y2Ba-4、7、10、13、16、19-二十二碳六烯酸(DHA)和GW1100购自Cayman Chemical (Ann Arbor, MI)。gydF4y2Ba
统计分析
使用韦尔奇t检验对数据进行分析。概率(p)值<0.05被认为具有统计学意义。gydF4y2Ba
EF后不同时间点HELP暴露对健康人血浆中肽激素和细胞因子的影响
18 kV HELP暴露前后15分钟的肽激素水平存在显著差异(表1)。暴露后即刻血浆GLP-1浓度较暴露前显著升高(1.86倍,gydF4y2BapgydF4y2Ba= 0.037)。与暴露前相比,HELP暴露后15分钟和45分钟血浆β-内啡肽浓度显著增加(15分钟:6.78倍,gydF4y2BapgydF4y2Ba= 0.030;45分钟:5.60倍,gydF4y2BapgydF4y2Ba=0.005),而HELP暴露后45分钟血浆α-MSH浓度较暴露前显著升高(1.46倍,gydF4y2BapgydF4y2Ba= 0.037)。在这些条件下,HELP暴露不影响CRH和ACTH的水平。此外,还分析了HELP在30 kV时对β-内啡肽水平的影响;45 min后/前时间点的相对比值为1.25 (gydF4y2BapgydF4y2Ba= 0.031)。gydF4y2Ba
由于外周神经末梢释放的神经肽被认为有助于调节内分泌系统和免疫系统之间的交流[13-15],我们还研究了18 kV HELP暴露15分钟对几种细胞因子的影响(表1)。与暴露前水平相比,HELP暴露后立即以及15和45分钟时间点的血浆IL-12浓度显著增加(0分钟:2.05倍,gydF4y2BapgydF4y2Ba= 0.042;15分钟:1.90倍,gydF4y2BapgydF4y2Ba= 0.003;45分钟:2.58倍,gydF4y2BapgydF4y2Ba= 0.002)。与暴露前相比,HELP暴露后15 min和45 min时,血浆IFN-γ浓度显著升高(15 min: 2.00倍;gydF4y2BapgydF4y2Ba= 0.019;45分钟:3.07倍,gydF4y2BapgydF4y2Ba=0.0001),与暴露前相比,HELP暴露45分钟后血浆IL-4浓度显著升高(1.62倍,gydF4y2BapgydF4y2Ba= 0.023)。在这些条件下,HELP暴露不影响IL-6和IL-10的水平。此外,还研究了HELP暴露对IL-12的影响,在30 kV处理15 min;15min前后时间点的相对比值为2.49 (gydF4y2BapgydF4y2Ba= 0.003)。gydF4y2Ba
DGLA在GPR40上靠泊gydF4y2Ba
已知急性EF暴露可引起健康受试者血浆DGLA水平显著升高[10]。已知DGLA可激活稳定表达GPR40[16]的HEK293细胞中的GPR40。因此,我们假设EF暴露后血浆DGLA水平升高可能与β-内啡肽水平的变化有关。因此,我们利用Sybyl-X2.0软件进行结合研究,探索DGLA与GPR40活性位点的相互作用。如图1所示,DGLA与Tyr91、Arg183、Arg258形成氢键,表明DGLA可以与GPR40结合。gydF4y2Ba
DGLA对人表皮角质形成细胞β-内啡肽分泌的影响gydF4y2Ba
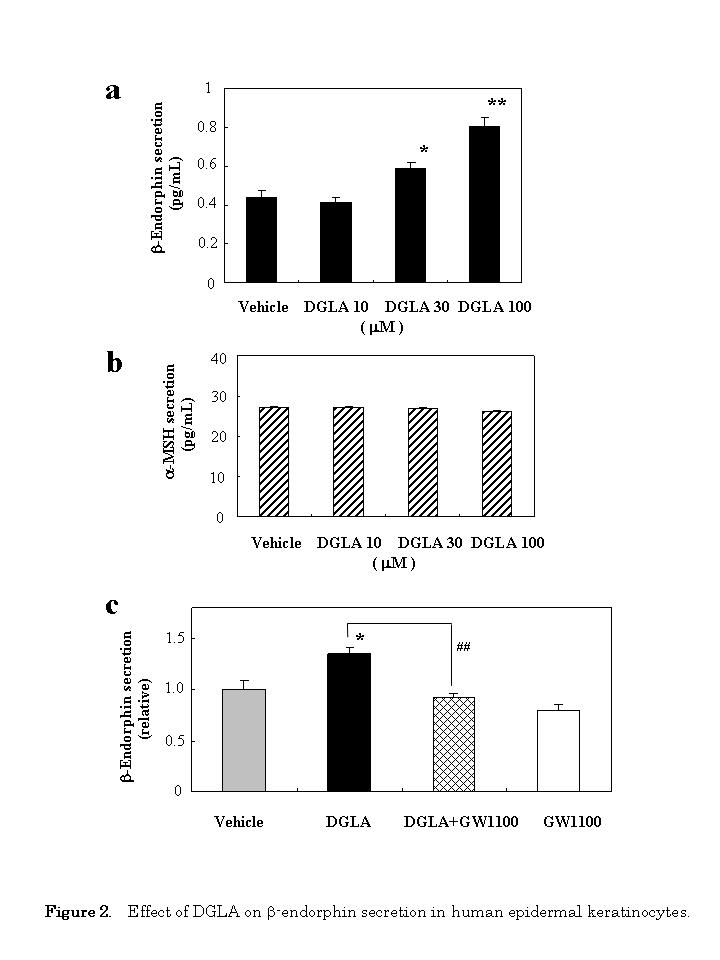
为了确定DGLA与GPR40对接是否会引起细胞功能的改变,我们利用人表皮角质形成细胞研究了DGLA对β-内啡肽分泌的影响。用DGLA处理人角质形成细胞,24 h后用ELISA检测β-内啡肽的分泌。如图2a所示,DGLA以剂量依赖的方式增加了培养液中β-内啡肽的分泌。在这些条件下,将细胞暴露在30 μMgydF4y2Ba独联体gydF4y2Ba-4、7、10、13、16、19-二十二碳六烯酸(DHA)对β-内啡肽的分泌没有影响(1.12倍,gydF4y2BapgydF4y2Ba= 0.252);DHA (100 μM)也进行了检测,但它本身具有细胞毒性(数据未显示)。gydF4y2Ba
为了确定DGLA的特异性,我们接下来检测了DGLA对α-MSH分泌的影响。DGLA在任何浓度下对α-MSH的分泌均无影响(图2b)。在此条件下,30 αM DHA对细胞的分泌无影响(0.99倍,0.99倍)。gydF4y2BapgydF4y2Ba= 0.154)。gydF4y2Ba
然后我们评估GPR40拮抗剂GW1100是否可以减弱dgla刺激的β-内啡肽分泌的作用。10 μM GW1100几乎完全消除了DGLA (30 μM)的刺激作用(图2c)。gydF4y2Ba
目前的结果清楚地表明,急性EF暴露会影响健康人血浆β-内啡肽水平。据报道,β-内啡肽、α-MSH和ACTH是前体肽proopiomelanocortin (POMC)在下丘脑-垂体系统[17]中的裂解产物。然而,我们的研究结果表明,EF暴露并没有改变ACTH或CRH,这是室旁下丘脑核的内源性促肾上腺皮质激素分泌的刺激物。有趣的是,表皮角质形成细胞中的POMC也被认为在β-内啡肽的血液水平中发挥关键作用[18-19]。事实上,最近的一项研究表明,血浆β-内啡肽水平可以通过低剂量的紫外线照射[19]升高。此外,KhodorovagydF4y2Ba等gydF4y2Ba.有报道称,有一种新的外周内源性镇痛回路可以诱导角质形成细胞[20]释放β-内啡肽。因此,角化细胞衍生的β-内啡肽可能影响,至少部分影响EF暴露诱导的血浆β-内啡肽水平的上调。gydF4y2Ba
在人类中,已经确定了四种游离脂肪酸(FFA)受体:GPR40 (FFA1受体)、GPR43 (FFA2受体)、GPR41 (FFA3受体)和GPR120 (FFA4受体)[21]。一种-6脂肪酸,gydF4y2Ba独联体gydF4y2Ba-8,11,14- eocosatrienoic acid (DGLA),据报道是gpr40[16]的内源性配体。我们之前已经表明,急性EF暴露诱导血浆DGLA水平增加约1.4倍[10]。当考虑到DGLA在血浆β-内啡肽水平变化中的作用时,Nakamoto最近报道称,侧脑室注射GPR40激动剂GW9508可诱导小鼠[22]弓状核中β-内啡肽的释放。GPR40由人表皮角质形成细胞[23]表达,在本研究中,DGLA可诱导人表皮角质形成细胞分泌β-内啡肽gydF4y2Ba在体外gydF4y2Ba而DHA则没有效果。这种反应被GPR40拮抗剂GW1100抑制。电话gydF4y2Ba等gydF4y2Ba.观察到用DGLA或DHA治疗会导致[CagydF4y2Ba2+gydF4y2Ba在HEK293细胞中稳定表达GPR40[16],与pECgydF4y2Ba50gydF4y2BaDGLA和DHA分别为5.14和5.37。这种明显的差异可能是由下列任何一种原因造成的:(i)用于功能分析的检测系统的差异:例如,增加细胞内钙的能力与增加β-内啡肽分泌的能力;或(ii)细胞培养系统的差异:例如,人胚胎肾293细胞与人表皮角质形成细胞。gydF4y2Ba
分子计算模型分析表明,DGLA可以与GPR40活性位点结合,其结合方式类似于TAK-875[24]。DGLA与GPR40的结合被发现是通过与Tyr91、Arg183和Arg258形成氢键而稳定的,而之前对GPR40与激动剂GW9508的研究报告了与Asn244和Ser247[25]的氢键。这种差异可能是由于模型系统的不同造成的;例如,4PHU(与变构激动剂TAK-875结合的人类GPR40的晶体结构)与1GZM(牛视紫红质三角晶体结构)。gydF4y2Ba
据报道,膳食脂肪可在大鼠[26]的血清和脑脊液中释放Β-endorphins。我们最近通过非靶向代谢组分析发现,EF暴露[10]诱导血浆DGLA水平升高。因此,EF暴露对血浆DGLA水平的上调可能至少部分地与GPR40信号级联有关。我们有理由推测EF暴露可能通过上调β-内啡肽来缓解疼痛。ShinbagydF4y2Ba等gydF4y2Ba.报告EF治疗3-4周后,慢性疼痛的视觉模拟疼痛评分值降低,无明显基础疾病[9]。虽然在本研究中没有进行重复的EF治疗,但EF治疗可能通过β-内啡肽激活阿片受体,至少部分地诱导镇痛。因此,有必要进一步研究EF对内源性DGLA/ β-内啡肽依赖信号通路的影响及其对治疗干预的影响。gydF4y2Ba
我们的研究结果表明,包括IL-12和IFN-γ在内的几种细胞因子在急性EF暴露中上调。迄今为止,关于EF暴露对细胞因子影响的研究还很少。大多数已发表的研究都是通过暴露于电磁场(EMF)进行的。萨利希gydF4y2Ba等gydF4y2Ba.在暴露于极低频电磁场(每天2小时,持续3个月)[27]后,大鼠血清中IL-12水平降低,而SelmaouigydF4y2Ba等gydF4y2Ba.报告急性电磁场暴露增加了健康年轻人血清中IL-6水平[28]。相反,我们发现EF暴露可导致Th1细胞因子IL-12和IFN-γ的上调,而Th17细胞因子IL-6则没有上调,这表明EF暴露可能至少部分参与了细胞介导的免疫。BaldridgegydF4y2Ba等gydF4y2Ba.最近有报道称,在慢性感染[29]时,造血干细胞被IFN-β激活。也有证据表明β-内啡肽的浓度在10gydF4y2Ba-10gydF4y2Ba和10gydF4y2Ba-13gydF4y2BaM对人自然杀伤(NK)细胞活性[30]有刺激作用。因此,可以想象,血浆IL-12和IFN-γ水平的升高,至少是部分原因,在接受EF治疗[31]的肺结核患者中可以看到改善。然而,目前尚不清楚细胞因子水平的变化是否归因于巨噬细胞、淋巴细胞或NK细胞。需要进一步研究明确EF暴露诱导的细胞因子信号通路,以及如何影响预防感染。gydF4y2Ba
综上所述,急性EF暴露对健康受试者血浆β-内啡肽水平有显著影响。在人表皮角质形成细胞中,DGLA诱导的β-内啡肽分泌对GPR40拮抗剂GW1100敏感。我们的发现不仅有助于阐明EF疗法减轻疼痛的分子机制,而且可能对替代医学策略的发展具有重要意义。gydF4y2Ba
YN-Y, HH, AH受雇于Hakuju Institute for Health Science Co., Ltd., YY受雇于Acel Inc., AM受雇于World Fusion Co., Ltd.所有其他作者都没有相互竞争的利益。gydF4y2Ba
YN-Y设计并指导研究,并撰写手稿。YN-Y、HH、AH进行EF暴露和生化实验。YY进行细胞培养实验。AM进行了分子建模。所有作者阅读并批准了这个手稿的最终版本。gydF4y2Ba
- Hara H(1961)交流静电高电压负荷对血液电解质的影响(日文)。gydF4y2Ba新泻医疗JgydF4y2Ba75: 265 - 273。gydF4y2Ba
- Ito F, Furuya K(1981)高压交流电对人体血压、内分泌系统和血脂变化的影响(日语)。gydF4y2Ba日本科学Balneol气候物理医学杂志gydF4y2Ba45: 6 - 17日。gydF4y2Ba
- Ito F, Furuya K(1981)高压交流电对人体血压、内分泌系统和血脂变化的影响(日语)。gydF4y2Ba日本科学Balneol气候物理医学杂志gydF4y2Ba45: 6 - 17日。gydF4y2Ba
- Nawarat S, Iomsai K, Jantanam P, Kauengtip Y(1999)电子健康加速器对非传染性疾病治疗的影响:泰国Petchaburi省Banlad医院的Casa研究(泰国)。gydF4y2Ba区域4医学JgydF4y2Ba18: 139 - 149。gydF4y2Ba
- 电场治疗仪(Healthtron)在治疗急性腰痛中的作用(日文)。gydF4y2Ba日本科学Balneol气候物理医学杂志gydF4y2Ba63: 127 -137。gydF4y2Ba
- Siripanichgon K, Otrakul A, Suparp J, Sirikulchayanonta C, Charupoonphol P (2000) Healthtron治疗的临床观察(泰国语)。gydF4y2BaJ公共卫生(曼谷)gydF4y2Ba30: 19-29。gydF4y2Ba
- Sirikulchayanonta C, Siripanichgon K, Otrakul A, Suparp J, Charupoonphol P (2001) Healthtron对中年人血脂水平的影响:初步报告。gydF4y2BaJ公共卫生(曼谷)gydF4y2Ba31日:63 - 70。gydF4y2Ba
- Owoeye O, Temiye E(2010)低压Healthtron治疗小儿脑瘫的疗效观察。gydF4y2Ba尼日利亚医学康复杂志gydF4y2Ba15: 17-22。gydF4y2Ba
- Shinba T, Takahashi K, Kanetaka S, Nedachi T, Yamaneki M, et al.(2012)电场治疗无明显基础疾病的慢性疼痛的初步研究(日文)。gydF4y2Ba日本综合医学中心gydF4y2Ba5: 68 - 72。gydF4y2Ba
- Nakagawa-Yagi Y, Hara H, Fujimori T, Yamaguchi T, Midorikawa A, et al.(2014)非靶向人类血浆代谢组学揭示了急性电场暴露对脂源性信号分子油酰乙醇酰胺的变化。gydF4y2Ba中国摩尔地中海gydF4y2Ba1: 29-37。gydF4y2Ba
- Lauffer LM, Iakoubov R, Brubaker PL (2009) GPR119是油乙醇酰胺诱导的肠内分泌l细胞分泌胰高血糖素样肽-1所必需的。gydF4y2Ba糖尿病gydF4y2Ba58: 1058 - 1066。[gydF4y2BaCrossrefgydF4y2Ba]gydF4y2Ba
- Nakagawa-Yagi Y, Sato Y, Matsumoto E, Nakatsuka S, Sakaki T, et al. (2012) Sasa senanensis亚临界水提取物对组蛋白去甲基化酶活性的药理调节延长了其寿命gydF4y2Ba黑腹果蝇gydF4y2Ba.gydF4y2BaBMC补充Altern MedgydF4y2Ba12: 101。[gydF4y2BaCrossrefgydF4y2Ba]gydF4y2Ba
- Bhardwaj RS, Luger TA(1994)表皮细胞产生proopiomelancortin:表皮免疫神经内分泌网络的证据。gydF4y2Ba拱北京医学ResgydF4y2Ba287: 85 - 90。[gydF4y2BaCrossrefgydF4y2Ba]gydF4y2Ba
- 关于神经内分泌-免疫相互作用的统一模型。gydF4y2BaImmunol细胞生物gydF4y2Ba79: 350 - 357。[gydF4y2BaCrossrefgydF4y2Ba]gydF4y2Ba
- Blalock JE(2005)免疫系统是第六感。gydF4y2BaJ实习生gydF4y2Ba257: 126 - 138。[gydF4y2BaCrossrefgydF4y2Ba]gydF4y2Ba
- Briscoe CP, Tadayyon M, Andrews JL, Benson WG, Chambers JK, et al.(2003)孤儿G蛋白偶联受体GPR40被中链和长链脂肪酸激活。gydF4y2BaJ临床生物化学gydF4y2Ba278: 11303 - 11311。[gydF4y2BaCrossrefgydF4y2Ba]gydF4y2Ba
- Pritchard LE, Turnbull AV, White A(2002)下丘脑的前阿片黑素皮质激素加工:对黑素皮质激素信号和肥胖的影响。gydF4y2BaJ性gydF4y2Ba172: 411 - 421。[gydF4y2BaCrossrefgydF4y2Ba]gydF4y2Ba
- Piomelli D, Sasso O(2014)内源性脂质介质对疼痛信号的外周门控。gydF4y2BaNat >gydF4y2Ba17: 164 - 174。gydF4y2Ba
- Fell GL, Robinson KC, Mao J, Woolf CJ, Fisher DE(2014)皮肤β-内啡肽介导紫外线成瘾。gydF4y2Ba细胞gydF4y2Ba157: 1527 - 1534。[gydF4y2BaCrossrefgydF4y2Ba]gydF4y2Ba
- Khodorova A, Navarro B, Jouaville LS, Murphy JE, Rice FL等(2003)内皮素-B受体激活在外周损伤部位触发内源性镇痛级联反应。gydF4y2BaNat地中海gydF4y2Ba9: 1055 - 1061。[gydF4y2BaCrossrefgydF4y2Ba]gydF4y2Ba
- Costanzi S, Neumann S, Gershengorn MC(2008)作为糖尿病治疗靶点的七种游离脂肪酸跨膜受体:药理学、系统发育和药物发现方面。gydF4y2BaJ临床生物化学gydF4y2Ba283: 16269 - 16273。[gydF4y2BaCrossrefgydF4y2Ba]gydF4y2Ba
- Nakamoto K, Nishinaka T, Sato N, Mankura M, Koyama Y, et al.(2013)游离长链脂肪酸激活下丘脑GPR40信号抑制cfa诱导的炎症性慢性疼痛。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba8: e81563。[gydF4y2BaCrossrefgydF4y2Ba]gydF4y2Ba
- Fujita T, Matsuoka T, Honda T, Kabashima K, Hirata T, et al. (2011) A GPR40激动剂GW9508抑制角质形成细胞中CCL5, CCL17和CXCL10的诱导,并减轻皮肤免疫炎症。gydF4y2BaJ投资北京医学gydF4y2Ba131: 1660 - 1667。[gydF4y2BaCrossrefgydF4y2Ba]gydF4y2Ba
- Srivastava A, Yano J, Hirozane Y, Kefala G, Gruswitz F, et al.(2014)人GPR40受体结合变构激动剂TAK-875的高分辨率结构。gydF4y2Ba自然gydF4y2Ba513: 124 - 127。[gydF4y2BaCrossref]gydF4y2Ba
- (in 2010) GPR40受体-激动剂相互作用的分子对接和分子动力学模拟研究。gydF4y2BaJ Mol图模型gydF4y2Ba28日:766 - 774。[gydF4y2BaCrossrefgydF4y2Ba]gydF4y2Ba
- Mizushige T, Saitoh K, Manabe Y, Nishizuka T, Taka Y, et al.(2009)大鼠对β -内啡肽释放诱导的膳食脂肪偏好。gydF4y2Ba生命科学gydF4y2Ba84: 760 - 765。[gydF4y2BaCrossrefgydF4y2Ba]gydF4y2Ba
- Salehi I, Sani KG, Zamani A(2013)将大鼠暴露于极低频电磁场(ELF-EMF)会改变细胞因子的产生。gydF4y2Ba地中海Electromagn杂志gydF4y2Ba32: 1 - 8。[gydF4y2BaCrossrefgydF4y2Ba]gydF4y2Ba
- Selmaoui B, Lambrozo J, Sackett-Lundeen L, Haus E, Touitou Y(2011)年轻健康男性急性暴露于50赫兹磁场可增加白细胞介素-6。gydF4y2Ba中国ImmunolgydF4y2Ba31日:1105 - 1111。[gydF4y2BaCrossrefgydF4y2Ba]gydF4y2Ba
- Baldridge MT, King KY, Boles NC, Weksberg DC, Goodell MA(2010)在慢性感染应答中,静止的造血干细胞被IFN-gamma激活。gydF4y2Ba自然gydF4y2Ba465: 793 - 797。[gydF4y2BaCrossrefgydF4y2Ba]gydF4y2Ba
- Williamson SA, Knight RA, Lightman SL, Hobbs JR(1988) -内啡肽对人体特异性免疫反应的影响。gydF4y2Ba免疫学gydF4y2Ba65: 47-51。[gydF4y2BaCrossrefgydF4y2Ba]gydF4y2Ba
- 石川(1929)结核病与物理治疗(日文)。见:J. Kawahara(编),临床医生的实践-最新临床结核病特刊,大同学馆出版社,福冈1204-1209。gydF4y2Ba