摘要
尽管有大量的基础研究和临床研究中的许多新疗法,心脏保护作为主要药理适应症仍然是一个空白的利基。本文对生长激素释放肽(GHRP)的研究进展及其临床定位进行了综述。GHRP是一组合成的小肽,刺激生长激素分泌和下游轴活性。两种特征明确的肽分泌素受体(GHSR 1a和CD36)广泛代表包括心血管系统。早期研究转变为一个新的研究时代,将合成GHRP作为有希望的心脏和细胞保护候选者。广泛的安全性和成功的临床前药理学培养了人们对GHRP家族成员之一(GHRP-6)作为心肌再灌注损伤减弱候选者的热情。在危及生命的情况下,虽然偶尔存在有效的、支离破碎的临床干预,以及GHRP-6在心肌梗死中的多因子作用机制,点燃了一个连贯的临床发展的主动性。
关键词
ghp, GHS, GH,心脏保护,细胞保护
缩写
AKT:蛋白激酶B, AMI:急性心肌梗死,ApoE:载脂蛋白E, CTGF:结缔组织生长因子,DCM:扩张性心肌病,dP/dt:收缩期早期左心室最大压升高率。一般是左心室整体收缩力的量度。DX:阿霉素,ECM:细胞外基质,EGF:表皮生长因子,ERK1/2:细胞外信号调节激酶1/2,GH:生长激素,GHRH:生长激素释放激素,GHRP:生长激素释放肽,GHS:生长激素促分泌激素,GHS- r:生长激素促分泌激素受体,GHSR-1a:生长激素促分泌激素受体生长激素促分泌受体1a, HIF-1α:缺氧诱导因子-1α, I/R:缺血再灌注,IGF-1:胰岛素样生长因子-1,IL-1β:白介素-1β, IL-6:白介素-6,LPS:脂多糖苷,LV:左心室,LVEF:左心室射血分数,MBP:平均血压,MIF:巨噬细胞迁移抑制因子MCP-1单核细胞趋化蛋白-1 MMP:基质金属蛋白酶MOD:多器官损伤,NEP:亚硝化最终产物,NIH:美国国立卫生研究院,PDGF:血小板衍生生长因子,PGC1α:过氧化物酶体增殖物激活受体γ共激活因子1- α, PI-3K磷脂酰肌醇-4,5-二磷酸3-激酶,PPARγ过氧化物酶体增殖物激活受体,p-PLB:磷酸化受磷蛋白,RAS:肾素-血管紧张素系统,rhGH:重组人生长激素,ROS:活性氧物种,TGF-β:转化生长因子,TIMP:金属蛋白酶组织抑制剂,tnf - α:肿瘤坏死因子。
介绍
美国内分泌学家西里尔·鲍尔斯(Cyril Bowers)发现了具有广泛细胞保护特性的肽基生长激素分泌物家族,他观察到脑啡肽酰胺的化学类似物与垂体培养物结合后显示生长激素释放活性。GHRP-6 (His-DTrp-Ala-Trp-DPhe-Lys-NH2)是首个诱导GH剂量相关释放的合成肽在体外和在活的有机体内[1]. 随后合成了七肽GHRP-1和另外两种六肽GHRP-2和六瑞林,并用于基础和零星临床研究。尽管在开始时,GHRP似乎是内分泌学家装备中的一种工具,但进一步的发现揭示了意想不到的药理学特性。GHRP家族成员开始因其阻止心肌细胞死亡的能力而大放异彩,从而在缺血/再灌注发作时诱导关键心脏功能的恢复[2,3]。新一代有前途的心脏保护剂开始兴起,并在内分泌学和心脏病学之间架起了一座桥梁。
尽管一些最重要的生物医学发现的历史中充满了意外发现[4],我们认为已经确定的生长激素/胰岛素样生长因子-1 (IGF-1)轴在心肌细胞生理学中的关键作用,在扩张型心肌病和左心室功能障碍的致病性中,这条轴的细微改变点燃了评估GHRP缓解心脏病理[5]潜能的想法。然而,在那些早期的研究中,ghrp介导的促心和细胞保护作用远远优于那些由生长激素的外源性管理所显示的作用,而GHRH不具有这些作用,而且重要的是,GHRP通过gh独立的途径发挥其药理作用,这显然代表了历史上的另一个转折点[3]。
这些先驱者合成的、非内源性GHRP的多年工作取得的进展和积累的经验,逐渐导致Ghrelin的发现,胃细胞分泌的具有gh释放作用的28氨基酸激素[6,7],具有食欲生成、细胞能量和代谢控制;以及对无数细胞群的心脏和细胞保护能力[8]。这种内源性GHS可能是研究最透彻的gh促分泌剂,各种合成类似物和受体逆激动剂已经开发出来[9-12]。
GHRP-6是一种小分子量的多肽,口服有效,稳定,经济上价格较其他[13]低。重要的是,我们观察到GHRP-6静脉给药在一项扩大剂量的健康人体志愿者临床试验中证明是安全的。同样相关的是GHRP-6的药理“定位”,我们的论证是没有的在活的有机体内该肽与一种经充分验证的心血管药物之间的药理学相互作用,如β受体阻滞剂metroprol[15]。由于GHRP-6多年来一直是我们实验工作的平台,我们将特别关注其研究发展,如hexarelin和GHRP-2。
本文试图从历史的角度对合成GHRP (GHRP-6、GHRP-2和Hexarelin)的药理学研究成果进行综述。由于这些肽基药物有助于发现细胞存活、衰老和死亡的新功能和机制,因此一般的细胞和心脏保护研究领域受到了特别关注。
搜索策略基于PUBMED/MEDLINE电子数据库,包括原始研究出版物和评论。搜索从1980年开始逐步升级,只包括英文文章。介绍了以下搜索词:GHS、GHRP、GHSR、CD36、心脏缺血/再灌注、心脏顿抑、心力衰竭、细胞保护和心脏保护。我们认为心脏病学家、临床医生、基础和临床药理学家将从本文中获得一些益处,与这些药物提供的未来药理学机会相对应。细胞保护仍然是当代医疗设备中的一个孤儿生态位。
重新定位GHRP
尽管GHRP具有强大和可重复的gh释放活性,但其作为口服活性生长促进剂和合成代谢抗衰老药物的临床应用仍有待证实。因此,作为生长激素替代疗法的初步热情并没有任何显著进展。然而,很可能是心肌、血管和GHRP受体的多器官表达加强了这些肽的心血管应用流。
一个了不起的具体(125)在人类心血管系统中观察到I-Tyr-Ala-hexarelin结合,在心室中检测到最高结合水平,其次是心房、主动脉、冠状动脉、颈动脉、心内膜和腔静脉。在H9c2心肌细胞的其他实验中,发现特异性GHRP结合以及有效的抗凋亡活性[3]。主要研究的受体是生长激素促分泌受体-1a(GHSR1a),在分离的人类心肌细胞、心肌和主动脉样本中检测到[17]。最近有研究表明,GHSR1a是一种“混杂受体”参与许多系统和行为模式,如奖励、喂养和记忆,是什么使其成为一个有吸引力的药理学靶点[18].几年后,合成的GHRP六瑞林被确认为另一种蛋白CD36的配体,CD36是一种清道夫受体,在各种组织中表达,包括单核细胞/巨噬细胞和内皮微血管。六瑞林在灌注心脏中激活CD36可在一种情况下增加冠状动脉灌注压硒依赖性。相反,CD36缺失小鼠的心脏和CD36基因缺陷的自发性高血压大鼠的心脏缺乏这种作用[19,20]。因此,目前公认有两种心脏受体亚型介导GHRP-6、GHRP-2和六肽的药理作用[21,22]。
心性证据
限制心肌缺血/再灌注损伤的重要性得到了重视,因为Braunwald提出组织损伤的程度和严重程度并不是在缺血开始时就预先确定的,而是可以通过在缺血期间应用的治疗手法加以修改的[22,24]。几年前,美国国立卫生研究院的一个专家小组得出结论说,心脏保护正处于十字路口,因为在过去30年里,确定心脏保护疗法的方法一直令人失望[25]。到目前为止所分析的多个候选者是通过中和一个环节来切断损害链,这一事实可能在某种程度上解释了不断增加的失败。心肌缺血/再灌注损伤涉及多种分子和生化机制,其中每一种机制都足以损伤到破坏一个依赖于离子/电泵稳定性的机械性能的器官。氧化应激、细胞内钙超载、pH变化、线粒体功能障碍、炎症和过量的神经激素是心肌损伤级联过程中相互作用和自我延续的连续体的一部分(图1)。提示该多肽家族中的每一个成员都能够同时对抗心肌缺血事件中不同的损伤操作。
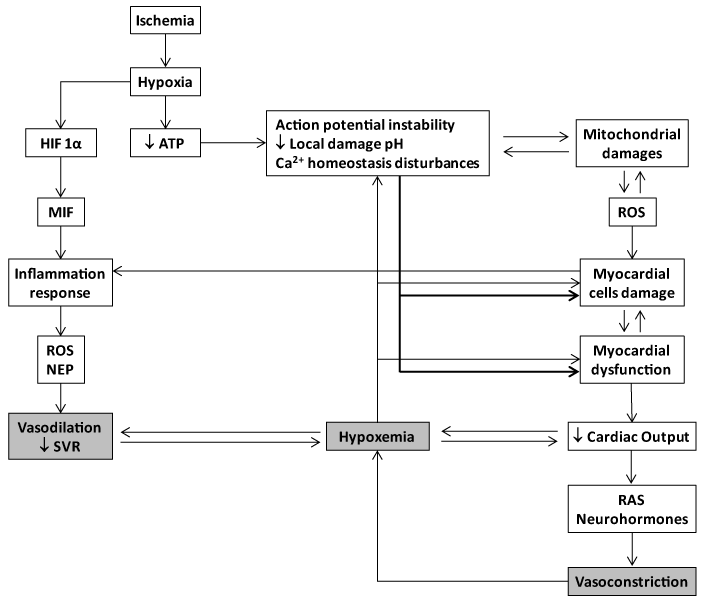
图1所示。急性心肌梗死的基本分子病理生理级联反应。当冠状动脉血流中断时,心肌能量需求与氧气和其他底物供应之间的供需不匹配导致心肌缺血。在缺血后,缺氧引发线粒体呼吸功能的急性衰竭时,弥散氧储存成为枯竭。因此,三磷酸腺苷(ATP)储备迅速耗尽,呼吸转向无氧状态。在这种情况下,乳酸,H+离子公司2,钾离子在缺血时由于出口衰竭而积聚。因此,心肌缺血是包括心律失常、微内皮损伤、心肌细胞休克和细胞死亡在内的缺血/再灌注损伤复合体的一部分。ATP耗尽不可逆转地与无法维持正常的静息膜电位负相关,与钙稳态(细胞内钙)的改变相关2+([Ca2+]我这可能最终导致不同类型的异常心脏收缩。当内膜可渗透溶质时,线粒体形态和功能变得异常(即.,钙),从而建立所谓的“开孔”(线粒体渗透率过渡孔- mptp)。以atp依赖泵的故障为K三磷酸腺苷,也是在缺血/ATP耗尽时开放的,是由于钾超载导致线粒体损伤的一个聚合的因果因素。mPTP参与心肌缺血/再灌注可促进局部细胞死亡。在这种情况下,线粒体变成一个活跃的ROS制造工厂,增加和延续线粒体损伤和功能障碍。心肌收缩力衰竭(收缩力下降)是缺血的早衰和多因素的结果,可能最终导致心输出量减少和心力衰竭。左心室起搏量减少,心输出量不足,可转化为全身内脏器官系统的有害后果,如果持续可能造成全身多器官缺氧环境,作为心源性休克和多器官衰竭的预期。全身和冠状动脉收缩是低冠状动脉压和心肌低灌注前的紧急代偿性肾上腺素能介导的反应。这种情况可能转化为自我持续的恶性循环,从而放大缺血发作和心肌壁应激。在心肌缺血/再灌注损伤过程中,局部炎症反应是一个有用但关键的操作。缺氧本身激活HIF-α/MIF轴和随后的炎症级联反应。HIF-α和NF-κB诱导炎症细胞募集,增强内皮细胞和损伤区黏附分子的表达。 Cells debris, scattered sequestered autoantigens, and locally-generated ROS, participate in the orchestration of the inflammatory response. At the end, the ischemia/reperfusion myocardial-targeted area secrete TNF-, IL-1, and IL-6. Again these cytokines are involved in a self-perpeatuating process in the ROS chain reaction. The systemic spillover of inflammatory mediators - including cytokines and NEP are potentially harmful for the systemic haemodynamic control. Systemic vascular resistance may drop down under such circumsatnces which may agravate the hypoxemia, the organs perfusion, and the myocardial injury.
1997年的实验研究证明,在通过服用抗GH释放激素(GHRH)血清免疫的GH缺乏动物中,六赖氨酸能够逆转心脏功能障碍。离体和在活的有机体内系统研究表明,即使在缺血后的情况下,hexarelin也能逐步和全面地改善左心室功能。这些实验的优点是表明合成的促分泌保护活性与任何进一步的刺激来自生长功能[26]。因此,在1998年,该小组证明了hexarelin对老年雄性大鼠的衰老心脏的缺血后心室功能障碍有保护作用。这两个体外和在活的有机体内GHRP提供了显著的心脏保护,防止再灌注休克,改善心室压力和容量,并降低CK浓度的灌注。再次,他们坚持的概念是,肽提供的保护可能是由于直接的心作用,这似乎远远大于同期对照组[27]GH诱导的作用。1999年提出了一项更明确的方案,因为该研究包括切除垂体的大鼠,以确定hexarelin是否对心脏有非gh介导的保护作用。在此背景下,作者表明,在垂体切除的动物[28]中,己糖脂可减轻缺血/再灌注损伤,防止左室舒张末期压、冠状动脉灌注压升高、冠状动脉血管对血管紧张素II的反应性和肌酸激酶的释放。这三个实验是确定GHRP内在的心脏保护能力的关键。
到1999年,7名患有生长激素缺乏和左心室衰竭的成年患者接受了hexarelin的注射。在这些患者中,已沙林对GH的反应可以忽略不计。此外,给药己糖林增加了他们的LVEF,但没有改变儿茶酚胺水平、平均血压或心输出量。第一次证明,急性给药己糖林在人体内诱导正性肌力作用,生长激素不依赖,并由特定的心肌受体介导生长激素促分泌肽[29]。随后的一项研究涉及给正常成年人、严重gh缺乏患者(N=7)和严重缺血性扩张型心肌病患者(N=12)使用己糖素,证实急性给药可发挥gh不依赖的正性肌力作用,可能是由特定ghrp心肌受体[30]介导的。这一开创性的研究小组随后评估了在接受旁路手术的患者中急性给药(2.0微克/公斤,静脉注射)与给予GH释放激素、重组人GH或安慰剂的患者的心脏性能。该研究得出的结论是,急性给药hexarelin可改善心脏功能,但不影响全身血管阻力的相关变化,诱导楔压降低,且显著的是,其他同期干预[31]没有显示出这些心功能。
这些人类受试者的研究与当代基础科学的实验进展相一致,该研究表明六蜡星林以剂量依赖性的方式促进H9c2心肌细胞增殖。由于这些是体外实验,完全排除了GH轴的潜在干预,明确表明GHRP与心肌细胞膜[32]直接结合。Van de Breghe组显示,GHRP-2预处理14天,而GH预处理对离体、灌注的兔心脏[33]缺血再灌注后的舒张功能障碍和心肌致休克有选择性保护作用。
以进行性左室扩张、左室壁变薄、左室收缩功能障碍和寿命缩短为特征的TO-2扩张型心肌病(DCM)仓鼠模型;GHRP-2和GHRP-6均能改善功能失调性心室参数,并降低DCM[34]的进展。我们还检测了GHRP-6在阿霉素(DX)诱导的DCM/心力衰竭大鼠模型中的潜在影响。同时给予GHRP-6的目的是研究在心功能衰竭前潜在的预防作用。作为DX延长治疗的一部分,同时给予GHRP-6完全防止了心功能衰竭,通过超声心动图评估射血分数的百分比(图2预防)。这种效果显著提高了动物的存活率。在给药方案中也得到了类似的结果,心肌功能恢复到生理水平(图2-回归),也减轻了全身损伤,从而降低了大鼠死亡率。在dx诱导的心脏和全身损伤的实验模型中,GHRP-6还能减轻肾小管和支气管肺泡上皮结构的各种心外损伤,如肝实质[35]。

图2。GHRP-6对扩张型心肌病(DMC)模型左心室射血分数的影响。
来自我们DMC模型的超声心动图数据,包括大鼠的预防和回归研究方案(见参考资料35).该预防方案设想同时给药GHRP-6,作为阿霉素长期治疗的一部分。根据超声心动图显示的射血分数百分比评价,伴随GHRP-6完全防止了心功能衰竭。当LVEF已经恶化时,回归方法检查GHRP-6干预。如图所示,治疗给药计划使心肌功能完全恢复。各实验组射血分数百分比(%EF)对应的数据以平均值±均值的标准误差表示。(*)表示使用安慰剂或GHRP6治疗组之间的统计学显著差异。学生´s t测试。
近年来,这些数据再次通过TO-2仓鼠DCM生物模型得到证实,在该模型中,GHRP-2通过抗氧化机制[36]降低了左室重构、功能障碍和随后的心肌纤维化的进展。上述心肌纤维化过程的改善揭示了GHRP在未满足医疗需求时的另一种潜在用途。在此背景下,己糖林对自发性高血压大鼠的慢性治疗,除了减轻心室肥厚、舒张功能障碍和高血压;通过降低间质和血管周心肌胶原沉积和心肌羟脯氨酸含量,显著降低心肌纤维化。从机制上讲,己糖林处理增加了基质金属蛋白酶(MMP)-2和MMP-9的活性,降低了组织金属蛋白酶抑制剂(TIMP)-1[37]心肌mRNA的表达。
本研究小组已经证实了GHRP-6在肝硬化[38]和增生性瘢痕动物模型中潜在的抗纤维化能力(Mendoza-Mari等)。已于2016年4月13日(周三)接受。整形外科国际)。2016年2月),通过ppar γ驱动级联,GHRP-6干预降低TGF-β1和CTGF的表达,这导致胶原蛋白和其他细胞外基质蛋白的积累显著减少。
默克研究实验室小组2003年的一份开创性报告首次证明,对扩张性心肌病犬模型进行GHRP-6慢性治疗(21天)可防止猝死,并随后导致急性心肌梗死(AMI)。与此同时,车辆和gh处理组的死亡率约为50%。虽然作者没有明确GHRP-6组100%生存率的机制,但推测非缺血区心肌代偿功能增强[39]。这一观点至少部分可以通过以下事实得到验证:在心肌细胞和分离的、去神经的、灌注的心脏中,GHRP-1、GHRP-2、GHRP-6和hexarelin显示的促心作用是由Ca的升高介导的2+通过电压门控钙通道,触发钙离子2+从thapsigarin敏感的细胞内储存释放,转译成正性肌力反应而无变时效应[40]。最近的数据证实了hexarelin和其他促分泌肽结合并激活GHS受体1a,以控制心脏动作电位和减少心肌细胞凋亡的能力,这些心肌细胞来自于受缺血/再灌注发作[41]的离体心脏。
与这些数据一致的是,我们组在健康和梗死兔单次注射GHRP-6(400µg/kg)后,观察到短暂性肌力作用约15分钟。超声心动图记录显示射血分数升高15-20%,同时缩短分数增加(Juan Valiente Mustelier和Jorge Berlanga Acosta)。未发表的观察,2007)。最近对经历缺血再灌注(I/R)期的离体小鼠心脏的研究证实,例如,六蜡脂素治疗前或治疗后可防止Ca细胞内紊乱+2I/R损伤后通过p-PLB恢复的瞬态[42]。涉及成年Wistar大鼠心室肌细胞的其他研究已经证实了六瑞林和其他结合GHS-R1a的促分泌肽诱导的正性肌力反应,它们激活蛋白激酶C信号级联[43]。
2005年,我们通过左旋动脉闭塞1小时后72小时再灌注进行了猪心肌梗死模型。GHRP-6挽救了缺血心肌70%以上的危险区域(图3),此外还增强了PI-3K、AKT、BCL2通路的存活信号通路/基因表达;GHRP-6降低了活性氧溢出,炎症标志物CRP,并保留了抗氧化防御[44]。当在ApoE(-/-)小鼠中检测GHRP-2的抗致瘤潜能时,这些抗氧化和抗炎特性也被归因于GHRP-2,因此12/15脂加氧酶、干扰素γ和巨噬细胞迁移抑制因子的基因表达被计算在内。此外,在培养的主动脉平滑肌细胞中,GHRP-2可阻止过氧化物的生成、IGF-1受体的下调和[45]的凋亡。

图3。形态学证据表明GHRP-6在猪心肌梗死模型中的作用。GHRP-6对AMI大小和严重程度的影响。A, B -用安慰剂治疗的动物AMI损伤的宏观和组织学图像。C, D-代表GHRP-6心脏保护作用的宏观和组织学图像。所有病例的组织学碎片均取自AMI坏死中心附近的明显正常区域。用GHRP-6治疗的大鼠表现出大部分保留或轻微损伤(肌浆水肿)的肌原纤维。未见肌纤维溶解,但出现一些幽灵核。(H / E×20放大)。
Hexarelin通过CD36的作用增加了脂肪细胞中脂肪酸动员向线粒体氧化磷酸化的多个基因的表达,这些上调的基因中有许多是过氧化物酶体增殖物激活受体(PPAR)- γ的已知靶点。与此相一致的是,电子显微镜下观察到经己蜡素处理的脂肪细胞形成了跨越整个线粒体宽度的高度有组织的嵴,同时细胞色素c氧化酶活性增强。虽然到目前为止还没有对心肌细胞的这种信号和激活级联反应进行描述,但这些在心脏中可能存在的磷酸化和线粒体形成机制,以及GHRP配体可能对其进行放大,最终可能有助于在严重缺血期间心肌的挽救。在最近的一项基于心肌梗死模型的研究中,研究了己糖脂治疗是否可以弥补胃饥饿素基因缺失小鼠的胃饥饿素缺失,发现己糖脂组(6.7%)和胃饥饿素组(14.3%)2周内的死亡率明显低于对照组(50%)。此外,从射血分数和其他左心室依赖的生理常数dP/dt max和dP/dt min[47]来看,hexarelin比ghrelin更有效。
在横纹肌萎缩的心外模型中,GHRP-2可能发挥了强大的肌保护作用通过直接激动性刺激GHS-R1a,因为在[48]中没有观察到IGF-1转录本的升高。因此,GHRP在扩张型心肌病中的心脏保护作用可能是由营养或合成代谢机制介导的。基于GHRP-6对肌肉功能的益处,一种新合成的GHRP-6生物素结合物在培养成肌细胞上的实验表明,可以诱导肌原蛋白的表达,IGF-1的水平作为能量代谢物和相应的酶的浓度。ghrp -6-生物素结合物的实际应用包括改善肌肉减少症和/或心脏恶病质[49]。
GHRP的心外细胞保护作用
根据Pubmed结果判断,合成肽基GHRP的细胞保护作用在非心脏、实质上皮器官或多器官系统中的研究远远少于在心血管系统中的研究。然而,从回顾的研究中得出的教训与通过减少炎症、防止坏死和/或细胞凋亡对各种内脏和非内脏器官具有广泛的细胞保护作用是一致的。图4总结了ghrp介导的药理作用。

图4。GHRP的作用机制。GHRP具有结合两种不同受体的能力,这两种受体似乎介导了它的细胞保护和其他药理特性。GHSR1a是主要研究的受体,负责促分泌和其他相关生理活动。已在分离的人心肌细胞和其他组织中的内皮细胞中检测到它。多年后,在心肌中发现CD36,并显示其介导其他非促分泌GHRP的生物学作用。CD36在灌注心脏中的激活以剂量依赖性的方式增加冠状动脉灌注压。与野生型对照相比,CD36缺失小鼠心肌对缺血/再灌注表现出明显的脆弱性。GHRP-6作为细胞和心脏保护候选者的主要生物学特性/药理作用总结如下:变力。它似乎是由Ca升高介导的2+涌入通过PLC/DAG/PKC,通过电压门控钙通道,触发钙离子通道2+从thapsigargin敏感的细胞内储存释放,转化为正性肌力反应,无变时效应。Anti-fibrotic。根据我们的数据,CIGB 500上调了PPAR- gamma,随后下调了TGF-beta、CTGF和PDGF。抗炎.减弱NF。kB的表达和激活以及随后的促炎级联反应。减少ROS, NEP,激活SOD的表达和活性。细胞生存.
它涉及到磷脂酰肌醇-3激酶/蛋白激酶B (PI-3K/PKB), Akt通路,以及缺氧诱导因子-1α (HIF-1α)的诱导,这些都参与了细胞对致命损伤的存活。心脏保护.它涉及到不同的生物活动,这些活动集中在一起以增强心肌细胞的存活。即减少ROS和NEP的细胞毒性,减少神经激素等。
血管扩张性。这似乎涉及内皮素和内皮素活性的降低以及e-NOS的上调。合成代谢.它是由IGF-1/Akt和mTOR通路活性介导的。
我们研究了GHRP-6在I/R大鼠肝组织模型中的细胞保护作用,以及来自缺血部位的其他远端器官(也就是说,肺、肾和小肠)。组织学和生化数据使我们得出结论,GHRP-6治疗诱导的药物预处理减轻了I/R肝损伤。此外,呼吸窘迫综合征(如肺部显微镜改变、肠壁梗死和肾脏急性肾小管坏死)显著减少(图5)。这些结果首次表明,GHRP-6具有全身性细胞保护作用,表明其在控制与急性I/R和休克相关的全身炎症反应综合征方面的潜在功效,最终导致多器官损伤(MOD)。我们还观察到,GHRP-6处理诱导的细胞保护也与活性氧(ROS)生成的减弱和抗氧化防御储备的保存有关。作为髓过氧化物酶活性评估的组织学分析证明,GHRP-6在肝脏和远端器官中具有明显的抗炎作用。此外,介导GHRP-6肽作用的分子机制(图6)涉及磷脂酰肌醇-3激酶/蛋白激酶B(PI-3K/PKB),Akt途径,作为缺氧诱导因子-1α(HIF-1α)的诱导,所有这些都致力于细胞存活[50]。在我们的研究之后,格拉纳多及其同事[51]研究了GHRP-2对LPS攻击大鼠的潜在抗炎作用。在这种情况下,通过与肝非实质细胞的直接相互作用,给予GHRP-2可减弱LPS对转氨酶、亚硝酸盐/硝酸盐和TNF-α循环水平升高的影响。从全球范围来看,外源性给予这两种合成GHRP似乎通过减弱驻留在肝脏的巨噬细胞引起的炎症反应发挥了强大的肝脏保护作用。另一系列证据表明,在关节炎大鼠中每天注射15次GHRP-2(100微克/千克)的益处,因此该治疗改善了关节炎的外部症状,并降低了IL-6的循环水平,因为在体外腹腔巨噬细胞释放亚硝酸盐/硝酸盐。该实验将GHRP-2的抗炎特性外推至非上皮器官,并再次表明与免疫细胞的ghrelin受体直接相互作用[52]。类似地,Ghrelin通过Akt激活途径抑制炎症反应,同时降低髓过氧化物酶活性、凋亡率和氧化应激,从而发挥作用[53]。所有这些数据表明,GHRP通过直接保护实质器官上皮细胞,同时通过与效应免疫细胞的直接相互作用调节炎症反应的幅度,发挥相互包容的有益作用。支持GHRP-6对上皮器官的保护作用,最近的一项研究出色地描述和剖析了GHRP-6如何预防浸水约束(WRS)和其他形式应激引起的胃粘膜损伤的机制基础。数据表明,GHRP-6对WRS诱导的胃粘膜损伤的保护作用在某种程度上是通过外周抑制迷走神经对胃的传出效应,包括胃酸分泌介导的。尽管需要进行更多的研究,但目前的研究结果为使用GHRP-6预防卷曲溃疡提供了可能性[54]。

图5。GHRP-6多器官保护的代表性图像。A栏-肝脏切片。黑色箭头表示安慰剂组肝坏死散在灶。与之形成鲜明对比的是,用GHRP-6治疗的动物只表现出轻微的正弦扩张。B柱-支气管切片。在接受安慰剂的动物中,上皮细胞层的严重损伤和腔脱落与用药组中检测到的上皮完整性形成了鲜明对比。列c -小肠图像,其中显示了安慰剂和GHRP-6介导的保护之间的实质差异。对于前者,描述了受透壁上皮凝固性坏死影响的部分。用GHRP-6治疗的动物出现轻度水肿。D柱-肾髓质切片。安慰剂组主要表现为小管上皮坏死。 For the GHRP-6 medicated group epithelial cells were mostly intact or mildly flattened.
2021年版权燕麦。所有权利reserv

图6。GHSR-1A介导的细胞保护机制。GHRP-6与GHSR的激动性结合引发了两种与生长激素分泌无关的主要生物学反应:细胞存活和细胞增殖。PI-3K酶的激活很可能是一种近端触发器,正如其他参与细胞保护和增殖的不相关配体和受体所显示的那样。这种酶的激活促进了A的磷酸化kt和RAS。A.kt或PKB在细胞存活、代谢和细胞生长中起作用。然而,一个kt是一种通过增强Bcl2和BCLx / L对抗促凋亡蛋白(BAX, BAD)。mTOR激活通过Akt诱导HIF-1α的表达,HIF-1α是缺氧时的一种促生存蛋白。HIF可能被RAF交替刺激,RAF在增殖级联中位于RAS的下游通过的兵。
此外,GHRP-6似乎是与其他分子(即EGF)结合的极好伙伴,因为它们的独特作用似乎实现了一种协同作用,有助于靶向复杂病理生理过程的多个节点,从而增强组织修复过程[55].在这方面,Garcia del Barco和我们小组的同事通过结合GHRP-6和EGF作为治疗方法,在动物模型中改善多发性硬化[56]、周围轴突病理[57]和脑缺血[58,59]的损害,开辟了前所未有的途径他们在所有这些实验底物中证明,GHRP-6和EGF的联合作用与临床和病理领域的更好结果相关。
最后,一个令人兴奋的医疗机会可能打开合成GHRP治疗威胁癌症相关性厌食症-恶病质综合征的晚期癌症患者。虽然这种综合征的机制基础尚不完全清楚,但它是化疗过程中的一个主要障碍。在啮齿动物癌症化疗模型中,给药GHRP-2增加了食欲/食物摄入量,延长了中位生存时间,这当然表明GHRP-2可能通过纠正其营养和代谢状态来改善癌症患者的生活质量[60]。这些数据也激发了进一步的研究,以寻找GHRP的潜在生态位,以对抗长期危重疾病、侵入性手术、严重烧伤创伤等的分解代谢状态。
结束语
药物发现是一个不确定的领域,在其中会遇到失望和回报。大多数参与GHRP研究的人都得到了明确的数据,在大多数情况下,这些数据都是完全正确的,只有很少的例外。特别的是,一种药理学活性物质似乎被赋予了如此不同和有用的特性,从而使它高度“可用药”。合成的GHRP具有结合至少两种不同的、在生物学上具有重要意义的受体的能力,而这两种受体在自然界中似乎不是多余的,而且这些受体主要存在于大多数器官和组织中;拓宽其生物活性,增加其药理潜力。这表明GHRP可能刺激多个细胞,同时触发不同的信号通路。到目前为止,关于GHRP分子细胞保护机制所收集的信息是不确定的和零碎的,这使得揭示其生物效应背后的魔法变得困难。然而,合理的是,这些分子共享的能力敲碎生命敏感的途径和恢复关键的细胞器生理在非常近的水平。
GHRP成员不仅能促进GH分泌,还能提高GH/IGF-1轴的肥力。它们也被证明是心血管、神经和广泛的细胞保护候选者。下面是几个直言不讳的例子:控制心脏电势和离子泵,心肌营养增强,心肌细胞存活,炎症可溶性信使和远端细胞效应的衰减,改善神经激素对心肌的影响,控制周围血管张力,预防多种上皮和非上皮结构的坏死和凋亡,通过去除纤维化物质促进组织重塑,通过刺激骨骼肌营养作用控制肌肉减少症,减少恶病质和分解代谢,化疗方案前的一般细胞保护,没有相关的增殖刺激。尽管GHRP表现出广泛的安全性和毒理学特征,但其临床开发一直不稳定且偶尔出现,尽管取得了成功,这可能阻碍了它在心脏病学和强化医学领域的定位。同时,需要新的药物和治疗策略来保护暴露于缺血的器官和组织。
参考文献
- Bowers CY, Momany FA, Reynolds GA, Hong A(1984)一种新的合成六肽在体内和体外的活性,它作用于垂体并特异性释放生长激素。内分泌学114: 1537 - 1545。[Crossref]
- Corneli G, Gasco V, Prodam F, Grottoli S, aiaretti G, et al.(2007)生长激素水平在成人生长激素缺乏诊断中的作用。垂体10: 141 - 149。[Crossref]
- Muccioli G, Broglio F, Valetto MR, Ghè C, Catapano F, et al.(2000)生长激素释放肽与心血管系统。安性(巴黎)第27 - 31 61:。[Crossref]
- Szeto HH(2014)首个用于线粒体生物能恢复的心脏磷脂保护化合物。Br J杂志171: 2029 - 2050。[Crossref]
- (1)扩张型心肌病患者生长激素/IGF-I轴的活性。性(Oxf): 417 - 430。[Crossref]
- Bowers CY(1998)生长激素释放肽(GHRP)。细胞分子生命科学54: 1316-1329. [Crossref]
- Ghrelin是一种来自胃的生长激素释放酰基化肽。自然402: 656 - 660。[Crossref]
- 根AW,根MJ(2002)人生长激素及其分泌剂的临床药理学。咕咕叫药物靶向免疫内分泌代谢紊乱2: 27-52。[Crossref]
- Bhattacharya SK, Andrews K, Beveridge R, Cameron KO, Chen C, et al.(2014)发现PF-5190457,一种有效的、选择性的、口服生物可利用的Ghrelin受体反向激动剂临床候选药物。美国医学化学快报8、5(5):474 - 9。[Crossref]
- Khatib MN, Simkhada P, Gode D (2014) ghrelin在心力衰竭中的心脏保护作用:从肠道到心脏。核心的观点15: 74 - 76。[Crossref]
- Kishimoto I, Tokudome T, Hosoda H, Miyazato M, Kangawa K (2012) Ghrelin与心血管疾病。心功能杂志59: 8日至13日。[Crossref]
- Anamorelin HCl (ONO-7643)是一种新的胃饥饿素受体激动剂,用于治疗癌症厌食症-恶病质综合征:临床前研究。恶病质肌少症5: 329 - 37。[Crossref]
- Broglio F, Arvat E, Gottero C, Benso A, Prodam F, et al.(2003)天然和合成生长激素分泌剂:它们有治疗潜力吗?治疗内分泌2: 153 - 163。[Crossref]
- selman - housin - bernal KH, Hernández-Bernal F, abru - cruz AA, Valenzuela-Silva C, Berlanga-Acosta J, et al. (2014) Seguridad clínica del péptido liberador de la hormone de crecimiento-6 (GHRP-6) en voltarios sanos。Investigaciones medico-quirurgicas6: 81 - 91。
- Valiente-Mustelier J, Garcia del Barco D, Guillen-Nieto G, Santana H, Altruda F, et al. (2013) GHRP-6的促心作用:超声心动图在体内的表征。Biotecnologia Aplicada30: 285 - 289。
- 王志强,王志强(2006)生长激素及其释放肽对心肌病的治疗作用。Cardiovasc Res69: 26 - 35周不等。[Crossref]
- 张刚,尹旭,齐勇,彭雅拉,陈静,等。(2010)胃饥饿素与心血管疾病的关系。咕咕叫心功能杂志牧师6: 62 - 70。[Crossref]
- Wellman M, Abizaid A1(2015)生长激素促分泌受体二聚体:一个新的药理学靶点(1,2,3)。eNeuro 2.[Crossref]
- Demers A, McNicoll N, Febbraio M, Servant M, Marleau S, et al. (2004) CD36中生长激素释放肽结合位点的鉴定:光亲和交联研究。物化学J382: 417 - 24。[Crossref]
- Bodart V,Febbraio M,Demers A,McNicoll N,Pohankova P等(2002)CD36介导心脏中生长激素释放肽的心血管作用。中国保监会Res90: 844-849. [Crossref]
- (2015)胃饥饿素和己糖素在糖尿病和糖尿病相关心脏病中的作用。内分泌49: 307 - 323。[Crossref]
- (2014)己糖素对心血管的作用。老年心脏病杂志11: 253 - 258。[Crossref]
- Braunwald E1(2011)降低心肌梗死面积的临床努力——下一步。心血管药理学杂志16: 349 - 353。[Crossref]
- Braunwald E1(2013)心血管科学:将研究转化为改善护理的机会。中国投资123: 6 - 10。[Crossref]
- Bolli R, Becker L, Gross G, Mentzer R Jr, Balshaw D,等(2004)心肌保护处于十字路口:需要转化为临床治疗。中国保监会Res95: 125-134. [Crossref]
- (1)生长激素缺乏的大鼠心肌缺血和血管内皮功能的损伤:己糖林的保护作用。欧元J杂志334: 201 - 207。[Crossref]
- 罗松尼,德Gennaro Colonna V, Bernareggi M, Polvani GL, Müller EE, et al. (1998) hexarelin或生长激素对老年大鼠缺血后心室功能障碍的保护作用。心血管药理学杂志32: 260-265. [Crossref]
- Locatelli V, Rossoni G, Schweiger F, Torsello A, De Gennaro Colonna V, et al. (1999) hexarelin对大鼠生长激素非依赖性的心脏保护作用。内分泌学140: 4024 - 4031。[Crossref]
- 比西,波迪欧,瓦莱托,布鲁里奥,贝尔图乔,等(1999)己糖林对垂体下垂体成人心脏的影响。欧元J杂志381: 31-38。[Crossref]
- Broglio F, Benso A, Valetto MR, Gottero C, Quaranta L, et al.(2001)生长激素释放肽在正常受试者、生长激素缺乏患者和特发性或缺血性扩张性心肌病患者中的非生长激素依赖性的促心活性。内分泌14: 105 - 108。[Crossref]
- Broglio F, Guarracino F, Benso A, Gottero C, Prodam F, Granata R, et al.(2002)急性己糖林给药对冠状动脉旁路手术患者心脏功能的影响。欧元J杂志448: 193 - 200。[Crossref]
- petersson I, Muccioli G, Granata R, Deghenghi R, Ghigo E, et al.(2002)天然(ghrelin)和合成(hexarelin) GH secretagoggues刺激H9c2心肌细胞增殖。J性175: 201 - 209。[Crossref]
- Weekers F, Van HE, Isgaard J, Van den Berghe G(2000)在离体血灌注兔心脏模型中,生长激素释放肽-2预处理可直接防止心肌休克舒张功能障碍。内分泌学141: 3993 - 3999。[Crossref]
- Iwase M, Kanazawa H, Kato Y, Nishizawa T, Somura F, et al.(2004)生长激素释放肽可改善扩张型心肌病仓鼠的左心室功能障碍并减轻其扩张。Cardiovasc Res61:此前。[Crossref]
- Cibrian D, Berlanga-Acosta J, Guevara L, Valiente-Mustelier J, Guillen-Nieto G, et al. (2008) Efecto citoprotector cardíaco y extracardíaco del péptido GHRP6。Biotecnologia Aplicada25日:276 - 278。
- Kato Y, Iwase M, Ichihara S, Kanazawa H, Hashimoto K, et al.(2010)生长激素释放肽对扩张型心肌病仓鼠心肌氧化应激和左心室功能障碍的有益影响。中国保监会J74: 163 - 170。[Crossref]
- 徐旭,丁芳,庞健,高旭,徐荣坤,等。(2012)慢性给药己糖林可减轻自发性高血压大鼠心肌纤维化。Am J Physiol Heart Circ Physiol303:H703-711。[Crossref]
- Berlanga-Acosta J, Vázquez D, Cibrian D, Mendoza Y, Ochogavia ME, et al.(2012)生长激素释放肽6 (GHRP6)降低慢性CCl4中毒大鼠肝纤维化。Biotecnologia Aplicada29: 60 - 72。
- Shen YT, Lynch JJ, Hargreaves RJ, Gould RJ(2003)在慢性扩张型心肌病犬中,一种生长激素促分泌剂可防止独立于生长激素途径的缺血性死亡。J药典306: 815-820.
- 徐晓波,曹建明,庞俊杰,徐荣科,倪超,等(2003)生长激素释放肽对大鼠心脏正性肌力作用和钙动员作用。内分泌学144: 5050 - 5057。[Crossref]
- (1)生长激素分泌剂对体外心肌缺血/再灌注小鼠心肌细胞电生理特性的影响。内分泌学153: 5480 - 5490。[Crossref]
- (1)生长激素促分泌剂对心肌缺血再灌注损伤的保护作用。《公共科学图书馆•综合》7: e35265。[Crossref]
- 孙强,马勇,张玲,赵艳芳,臧文军,等。(2010)GH分泌剂对离体成年大鼠心室肌细胞收缩力和Ca2+稳态的影响。内分泌学151: 4446 - 4454。[Crossref]
- Berlanga J, Cibrian D, Guevara L, Dominguez H, Alba JS等(2007)在急性心肌梗死模型中,生长激素释放肽6 (GHRP6)可预防氧化细胞毒性并减少心肌坏死。临床科学(伦敦)112: 241-250. [Crossref]
- titerington JS, Sukhanov S, Higashi Y, Vaughn C, Bowers C, Delafontaine P(2009)生长激素释放肽-2抑制ApoE-/-小鼠的血管氧化应激,但不减少动脉粥样硬化。内分泌学150: 5478 - 5487。[Crossref]
- rodrige - way A, Demers A, Ong H, Tremblay A(2007)在白色脂肪细胞中,一种生长激素释放肽通过清除受体CD36促进线粒体生物发生和脂肪燃烧样表型。内分泌学148:1009 - 1018。[Crossref]
- Mao Y, Tokudome T, Kishimoto I, Otani K, Hosoda H, et al. (2013) Hexarelin治疗心肌梗死后ghrelin敲除小鼠。内分泌学154: 3847 - 3854。[Crossref]
- Yamamoto D, Ikeshita N, Matsubara T, Tasaki H, Herningtyas EH, et al. (2008) GHS-R激动剂GHRP-2直接作用于肌细胞,减弱地塞米松诱导的肌肉特异性泛素连接酶、atroin -1和MuRF1的表达。生命科学82: 460 - 466。[Crossref]
- Lim CJ, Jeon JE, Jeong SK, Yoon SJ, Kwon SD, Lim J,等(2015)生长激素释放肽-生物素结合物通过胰岛素样生长因子-1和I型胶原刺激肌细胞分化。BMB代表48: 501 - 506。[Crossref]
- Cibrián D, Ajamieh H, Berlanga J, León OS, Alba JS, et al.(2006)使用生长激素释放肽-6 (GHRP-6)预防多器官衰竭。Sci (Lond)110: 563 - 573。[Crossref]
- Granado M,Martin AI,Lopez Menduina M,Lopez Calderon A,Villanua MA(2008)服用生长激素释放肽-2可预防内毒素血症时的肝脏炎症反应。J是生理内分泌吗金属底座294: E131-E141。[Crossref]
- Granado M, Priego T, Martín AI, Villanúa MA, López-Calderón A (2005) ghrelin激动剂生长激素释放肽-2 (GHRP-2)对关节炎大鼠的抗炎作用。我是生理内分泌Metab吗288:E486-492[Crossref]
- 关键词:胃饥饿素,体外循环,心脏保护作用,炎症反应《公共科学图书馆•综合》8: e55021。[Crossref]
- 郭树清,高强,焦强,郝伟,高旭,等。(2012)水浸应激对胃黏膜损伤的影响:GHRP-6的作用机制及预防。世界杂志18: 3145-3155. [Crossref]
- Rodriguez SS, Gonzalez NL, Garcia Del Barco HD, Santos FE, Maza AD,等(2014)表皮生长因子和生长激素释放肽-6在卡那霉素过量大鼠肾组织修复加速中的作用。伊朗J肾脏病8: 382-388. [Crossref]
- Del Barco DG, Montero E, Coro-Antich RM, Brown E, Suarez-Alba J, et al.(2011)表皮生长因子和生长激素释放肽-6联合给药可改善实验性自身免疫性脑炎的临床恢复。备份文件夹神经>.[Crossref]
- Del Barco DG, Perez-Saad H, Rodriguez V, Marin J, Falcon V,等(2011)联合应用生长激素释放肽-6和表皮生长因子对轴突病模型的治疗效果。Neurotox Res19日:195 - 209。[Crossref]
- Subiros N、Perez Saad HM、Berlanga JA、Aldana L、Garcia Illera G、Gibson CL等(2015年)对rhEGF和GHRP-6联合给药治疗中风的临床前研究中的剂量效应和治疗时间窗的评估。神经Res1743132815 y0000000089。[Crossref]
- Garcia b - h, Martinez NS, Coro-Antich RM, Machado JM, Alba JS, et al.(2013)表皮生长因子和生长激素释放肽-6联合治疗实验性脑卒中。备份文件夹神经>31日:213 - 223。[Crossref]
- Perboni S, Bowers C, Kojima S, Asakawa A, Inui A(2008)在结肠癌细胞携带小鼠中,生长激素释放肽2逆转与5-氟尿嘧啶化疗相关的厌食症。世界J杂志14: 6303 - 6305。[Crossref]







