目标:探讨急性胰腺炎大鼠模型在发病早期48小时内调节性T细胞(Treg)和IL-35的变化及其潜在意义。
方法:36只sd大鼠分为对照组(6只)和急性胰腺炎组(30只)。采用胆总管结扎法建立大鼠胰腺炎模型。在成功建立胰腺炎模型后,进行研究,并在2、6、12、24和48小时内每次处死6只大鼠。从CBD结扎开始计算持续时间。CD4+CD25+流式细胞术检测外周血T细胞。ELISA法测定血清IL-35。在所有阶段确定胰腺坏死的病理分级。
结果:与对照组相比,AP组在2、6、12、24和48小时内的Treg和IL-35显著降低。胰腺病理学评分随着疾病的进展而增加。
结论:根据我们的研究,调节性T细胞和IL-35均与AP组呈显著正相关,循环水平呈下降趋势,与胰腺病理分级呈负相关。
急性胰腺炎,病理分级,免疫改变,Treg,IL-35
急性胰腺炎是一种与高死亡率和高发病率相关的严重疾病。这种情况是指宿主免疫应激和免疫抑制活性失衡的状态。了解在病理生理过程中与生化调节剂的关系对于理解和治疗疾病非常重要。T调节细胞或Tregs和IL35是负责维持宿主的调节机制之一免疫反应和对自身抗原的耐受性与自身免疫性疾病过程有关。在急性胰腺炎的情况下,CD3的数量+CD4+T细胞和CD4+CD8+外周血中的比率降低。在疾病过程中,会产生各种炎症介质和细胞因子,导致免疫改变、感染状态增加以及器官功能丧失[1]。免疫系统具有自我调节能力和调节剂,其中Treg具有负免疫反馈[2-3]。尽管IL35的确切作用机制尚不清楚,但在不同种类的文献中已描述了其在免疫抑制中的作用[4]。在本研究中,我们旨在研究急性胰腺炎大鼠模型早期外周血中Treg和IL35的潜在相关性和变化。
从佳木斯大学动物实验中心收集36只S-D成年雄性大鼠,平均体重200克。
使用了以下仪器和试剂
LX-200掌上离心机(海门麒麟仪器厂)、FACS口径流式细胞仪(美国BD公司)、CD4抗体、CD25(金山桥公司)、白细胞介素35大鼠Elisa试剂盒(上海源公司)、-80℃超低温冷冻柜(日本三洋公司)、YBL-2生物组织包埋机、,HM-315组织切片机。
研究小组和建模
为了研究目的,将大鼠随机分为对照组(6只)和急性胰腺炎(AP)组(30只)。AP大鼠模型采用CBD(胆总管)结扎法建立[5]。适当喂养大鼠并将其保持在相同的环境条件下。结扎CBD前,AP组大鼠禁食12小时。腹腔注射水合脉络膜以诱导麻醉。在所有无菌预防措施下,剖腹手术采用腹正中切口;相应地识别并结扎CBD(图1)。伤口用间断缝线缝合,并用无菌敷料包扎。对照组为自由活动组。根据水肿、白细胞浸润、出血和坏死程度,采用吴建新分级评分计算胰腺病理分级[6]。
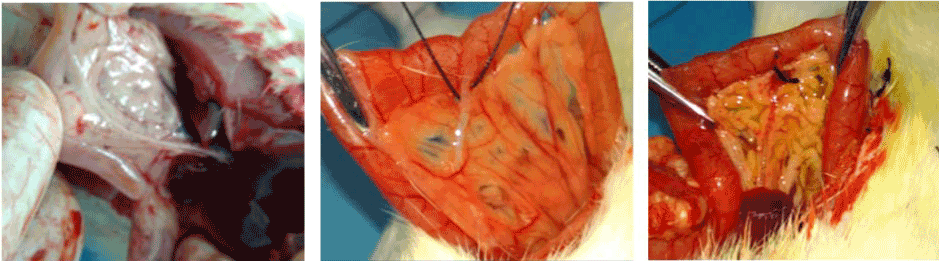
图1。(A、B和C):识别和结扎胆总管。
标本收集
在成功建立大鼠模型后,每次从AP组和对照组各采集一只大鼠的血液和组织样本。在含有抗凝剂的真空管中,在2小时、6小时、12小时、24小时和48小时后从每只大鼠的下腔静脉收集5毫升血液。从CBD结扎开始计算持续时间。血液样本在3000RPM下离心15分钟,并在-80°C下冷冻保存。收集胰腺标本,保存于甲醛溶液中,48小时后常规石蜡包埋。
胰腺组织病理分级及变化
收集胰腺组织样本,保存并相应制备。苏木精-伊红染色,显微镜下观察标本病理变化。收集样本的病理分级和评分根据吴建新参考文献[6]进行。
Treg和IL-35水平的评价
从每只大鼠的下腔静脉收集5毫升血液,放入真空管中。然后将血样稀释到肝素溶液中,观察并洗涤溶血,在12×75mm试管中分离淋巴细胞,与CD4和CD25抗体(中山金桥)混合,并在黑暗中培养20min。然后将试管放入流式细胞仪中。CD4+CD25+Treg的结果为平均值±标准偏差。采用标准酶联免疫吸附法测定IL-35。
采用SPSS17.0进行统计分析。进行卡方检验和皮尔逊相关分析。P值<0.05被认为是显著的。
胰腺组织的形态学和显微变化
对照组无明显变化。(图2a)显微镜下,腺泡小叶完整,间质清晰,间质轻度水肿。(图2b和2c)观察到出血、坏死和大量间质单核炎症细胞的显微镜证据(图3)。AP组腺泡小叶结构疏松、扭曲,充满胰腺间质水肿液(图4-8)。造模后胰腺病理改变随造模时间延长而加重。结果如表1所示。外周血中Treg和IL-35水平的变化及其与胰腺病理分级的相关性:

图2。(A,B和C):建模后胰腺和腹膜的形态学变化。A:正常胰腺,B&C:CBD结扎后胰腺和腹膜的变化。

图3。正常对照组(HE染色×400)

图4。AP模型组2h(HE染色×400)淋巴细胞轻度浸润,原发性水肿。

图5。AP模型组6h(HE染色×400)淋巴细胞中度浸润。

图6。AP模型组12h(HE染色×400)可见胰腺腺泡细胞内淋巴细胞浸润,有明显水肿改变。

图7。AP模型组24h(HE染色×400)腺泡结构部分缺失,大鼠水肿。

图8。AP模型组48h(HE染色×400)腺泡结构完全丧失。
在对照组中,血液Treg为2.706%,而在AP组中,平均值小于2%。AP组造模后2小时该值平均为1.735%。随着时间的推移,水平下降,在48小时的平均值中,最低值为0.744%(图9-13)。统计分析显示显著降低(P<0.05)[表1]。

图9。AP模型组2h

图10。AP模型组,6h

图11。AP模型组12h

图12。AP模型组24h

图13。AP模型组48h
对照组的IL-35水平为1.04±0.12 pg/ml,而实验组在2小时时的水平为0.74±0.17。该值逐渐降低,并在48小时时达到最低0.31±0.11 pg/ml(表1)。
表1。外周血中Treg和IL-35的变化。研究组胰腺的病理分级(X±S)。(注:与对照组比较,P<0.05,*P<0.05,^P<0.05)。
团体 |
Treg(%) |
IL-35(pg/ml)用于胰腺病理分级 |
对照组 |
2.71 ± 0.14 |
1.04 ± 0.12 0.00 ± 0.00 |
SAP2h |
1.74 ± 0.17# |
0.74 ± 0.17* 4.66 ± 1.37^ |
SAP6h |
1.29 ± 0.16# |
0.66 ± 0.43* 6.83 ± 1.33^ |
SAP12h |
1.10 ± 0.06# |
0.59 ± 0.59* 10.50 ± 1.38^ |
SAP24h |
1.05 ± 0.02# |
0.39 ± 0.33* 13.00 ± 1.41^ |
SAP48h |
0.74 ± 0.15# |
0.31 ± 0.11* 13.83 ± 1.70^ |
明光肉眼检查和显微镜下的病理分级显示,2小时至48小时的最大值为3.23至15.06。这显示出持续上升的趋势。
血清Treg水平与IL-35水平呈正相关(Pearson相关=0.398,P<0.05)。这两种类型的胰腺病理评分均为阴性(Pearson相关系数分别为0.869和0.407,P<0.05)。
急性胰腺炎可由多种病理生理机制触发,其中免疫系统受损起着一定的重要作用。在本研究中,我们试图评估胰腺炎症的发展阶段与循环中Treg和IL35水平变化之间的关系。我们的研究结果显示,在实验组(AP)中,Treg的血药浓度从2小时逐渐下降到48小时(P<0.05),同时胰腺病理评分逐渐增加。这证明了急性胰腺炎患者的Treg与胰腺病理改变之间存在显著相关性。CD4、CD25和Treg是具有负反馈效应的免疫介质。研究以多种方式描述了这种免疫抑制,其中IL-2途径起着最重要的作用[7]。T淋巴细胞的增殖受IL-2、Treg和CD25的影响。IL-2受体α链相互竞争效应细胞中的受体结合位点。Treg细胞的主导作用导致IL2和细胞因子的降低;这最终会抑制T细胞的快速生长。在急性胰腺炎的初始阶段,促炎反应起主导作用。随着疾病的进展,促炎和抗炎反应逐渐抑制免疫反应,IL-2水平降低。这种机制导致T淋巴细胞逐渐激活。在我们目前的研究中,AP组在2小时前与对照组的Treg百分比大致相同(图14),但与对照组相比,该水平随时间逐渐降低(图8-12)。因此,这一发现表明,在大鼠急性胰腺炎的初始阶段,Treg细胞水平降低和免疫过度激活可能发挥作用。丁震[8]和其他几种文献也描述了类似的发现。Dante's Peak进行的一项研究表明,建模6小时后,Treg水平显著下降。除此之外,我们的研究显示IL-35水平与急性胰腺炎显著相关。AP组大鼠模型中IL-35水平随着胰腺病理评分的升高而显著降低(P<0.05)。这一发现证实了最近对IL-35对淋巴细胞增殖和炎性细胞因子表达的负面影响的理解[9,10]。此外,由CD4、CD25和Treg激活的iTreg细胞可分泌IL-35,这对iTreg有积极影响[2].在急性胰腺炎的初始阶段,宿主免疫反应会对炎症产生负面影响。但在后期,由于促炎细胞因子活性增加,抑制反应受到抑制,这表现为循环IL-35水平随时间显著降低。

图14。光盘
总之,根据我们的研究,血清IL-35和Treg水平在大鼠急性胰腺炎的发展阶段具有重要的潜在作用。这一发现促进了对急性胰腺炎病理生理学的准确和全面的理解。我们相信这一发现将对急性胰腺炎的治疗和预后起到有效的指导作用。
本手稿的作者声明没有利益冲突。
作者要感谢消化系统疾病二科的所有医生和工作人员以及Chattagram Maa-O-Shishu医学院院长A S M Mostaque Ahmed教授(博士)的慷慨合作和支持。该研究得到了佳木斯大学第一附属医院当地伦理委员会的批准,并得到了项目基金的支持:佳木斯大学创新与技术研究生课题,编号:LM2015025。
- Kylanpaa ML,Repo H,Puolakkainen PA(2010)重症急性胰腺炎的炎症和免疫抑制。世界胃肠病学杂志16: 2867-2872.[交叉参考]
- Collison LW,Chaturvedi V,Henderson AL,Giacomin PR,Guy C,et AL.(2010)IL-35介导的有效调节性T细胞群诱导。纳特免疫11: 1093-1101.[交叉参考]
- Sakaguchi S(2011)《调节性T细胞:历史与展望》。方法采用分子生物学方法707: 3-17.[交叉参考]
- 罗成,季庆伟,林应忠(2012)白细胞介素-35的结构及其与疾病的关系研究进展。中国细胞与分子免疫学杂志28: 769-770
- 唐浩涛,薛兴(2014).急性胰腺炎实验动物模型的建立方法及研究进展[J]。中国普通外科最新进展杂志17: 412-414
- 吴建新,袁耀宗,徐家瑜(2002)急性坏死性胰腺炎大鼠模型病理特征评价方法研究[J]。动物科学实验室学报10: 210-212
- Buckner JH(2010)人类自身免疫疾病中CD4(+)CD25(+)FOXP3(+)调节性T细胞调节受损的机制。奈特免疫10: 849-859.[交叉参考]
- 丁震,林荣,钱伟(2007)CD4+CD25+细胞和大鼠早期免疫坏死性胰腺炎的发病率[J]。中国消化杂志27: 585-587
- Collison LW,Workman CJ,Kuo TT,Boyd K,Wang Y,等。(2007)抑制性细胞因子IL-35有助于调节T细胞功能。本性450: 566-569.[交叉参考]
- Liu F,Tong F,He Y,Liu H(2011)CD4中IL-35的可检测表达+慢性乙型肝炎患者外周血T细胞。临床免疫139: 1-5.[交叉参考]















