编辑信息
主编
伊凡痛风
文章类型
研究文章
出版的历史
收稿日期:2019年1月24日
接受日期:2019年2月13日
发布日期:2019年2月16日
版权
布埃诺SJ©2018。这是一篇开放获取的文章,在知识共享署名许可协议的条款下发布,该协议允许在任何媒体上无限制地使用、发布和复制,前提是注明原作者和来源。
引用
脑干细胞和IGF-I在发育、再生和癌症治疗中的意义。Integr Mol Med 5: DOI: 10.15761/IMM.1000319
哥伦比亚布卡拉曼加UNAB大学卫生科学学院
电子邮件:aa
哥伦比亚布卡拉曼加UNAB大学理学院
哥伦比亚布卡拉曼加UNAB大学理学院
哥伦比亚卡塔赫纳德印第亚斯卡塔赫纳大学医学院
ICGT和Legrand S.A.实验室,哥伦比亚波哥大,以及NSERM U602,法国维勒吉夫
哥伦比亚布卡拉曼加UNAB大学卫生科学学院
哥伦比亚布卡拉曼加UNAB大学卫生科学学院
ICGT和Legrand S.A.实验室,哥伦比亚波哥大,以及NSERM U602,法国维勒吉夫
DOI: 10.15761 / IMM.1000319
在过去的40年里,我们面临的挑战是利用我们对生命进化、蛋白质化学、遗传学和分子生物学的了解找到治疗脑瘤的方法。通过构建靶向肿瘤蛋白或生长因子(如IGF-I, AFP)的载体,以建立有效的治疗策略,这些肿瘤蛋白或生长因子在胚胎和胎儿神经系统组织发育过程中来源于神经干细胞。从小鼠畸胎瘤中提取的肿瘤干细胞PCC3和PCC4被转染了表达反义IGF-I RNA或IGF-I RNA的载体,形成一个三螺旋RNA- dna。这两种方法都完全停止了IGF-I生长因子的合成,并将干细胞转化为表达MHC-I和B7的免疫原性细胞。免疫原性抗IGF-I转染的细胞成为抗肿瘤疫苗。干细胞在神经系统中所扮演的角色激励着我们去寻找专注于自我再生和治疗策略的知识。抗IGF-I疫苗治疗胶质母细胞瘤的策略获得成功。
干细胞,IGF-I,神经系统发育,肿瘤,自我再生,治疗
大脑具有可塑性和自我再生能力。在神经发生中:全潜能未成熟细胞——神经干细胞(NSC)存在于海马体和脑室中,它们繁殖、分化和成熟并定居在大脑区域,在新环境中激活多个连接(突触)的过程,这个过程称为突触发生。神经系统干细胞NSC在寻找脑组织组织学、生理学和病理学新知识,包括肿瘤机制和抗肿瘤策略等方面产生重要影响[1-5]。
当NSC产生新的功能性神经元和胶质度时,神经发生在大脑中进行,考虑到它们是多能细胞,具有产生不同神经谱系的能力[1,6]。这一过程在胎儿发育期间开始,并且由于在海马的凹陷区(SVZ)[7,8]中存在NSC,持续存在于成人寿命中[9]的牙齿齿状回波的亚粒状区(SGZ)。神经发生受到饮食的不同方面的影响[10],运动[11]和睡眠[12]由于与增加的脑衍生的神经营养因子(BDNF)的产生或表达增殖和分化的基因的表达,睡眠[12].
NSC的发生与胰岛素样生长因子1及其受体(IGF-1R)有关;考虑到这是胚胎和肿瘤发展的趋同,IGF-I及其受体被提出作为治疗成胶质母细胞瘤进展的靶点[13,14]。这篇综述的目的是描述成人NSC,以及出生后生命发育过程中IGF-I、IGF-1R与NSC之间的关系。此外,IGF-I和IGF-IR作为免疫基因治疗胶质瘤的靶点也将被考虑。
Ramón y Cajal的研究震惊了世界,他们首次证明了微观神经元成分的复杂性。他们的一些结论支持了这样一个概念:我们出生时,有一定数量的神经元保持不变,然后这些细胞中的许多在生命过程中死亡,由于凋亡过程,内皮细胞受损
脑血管或高脂血症。100多年来,神经学研究确立了这样一个信条:成年人的大脑保持稳定,神经元数量没有增加变化,处理和记忆能力处于不可逆转的退化状态,这是由于神经元数量随时间的推移而减少。人类适应了这种渐进退化的概念,导致了智力的低下。20世纪90年代,电子显微镜和分子生物学的发展改变了这一范式:在海马和脑室分化过程中发现了全能干细胞(NSC)的存在和增殖。此外,分化过程与负责神经元成熟、自我再生、突触发生和大脑可塑性的生长因子之间的关系。后者允许承担受损伤或疾病影响的神经元的功能,允许受损功能的恢复。自2002年以来,随着神经干细胞的存在和繁殖的范式通过新的证据得到巩固,对神经干细胞(NSC)的信息进行了综述[15,16]。
就神经系统描述的历史而言,Santiago Ramon y Cajal首先详细描述了中枢神经系统(CNS)和神经元。1965年Altman证明成年大鼠海马中存在神经发生,在齿状回[17]的颗粒细胞区(SGZ)和侧脑室的室下区(V-SVZ)均存在[7,18]。V-SVZ细胞有4种类型:A型细胞为神经母细胞,B1和B2型细胞为星形胶质细胞,C型细胞为增殖前体,E型细胞为室管膜细胞[7,8],其中只有B1型具有NSC特征。B1型细胞的末端位于血管上。该细胞具有胶质标志物,如胶质纤维酸性蛋白(GFAP)、谷氨酸天冬氨酸转运蛋白(GLAST)、脑脂结合蛋白(BLBP)等[8,19]。当B1细胞增殖时,不对称分裂产生C型细胞并进行自我更新[20,21]。在产生C型细胞后,它们再次分裂并产生神经母细胞或A型细胞。最后一部分增生并迁移到吻侧迁移流(RMS),这导致嗅球(OB)[22],在那里它们成为gaba能抑制中间神经元[7,23]。
至于由不同层组成的齿状回(DG)的作用,其中之一是NSC集中的亚颗粒区(SBZ)[24]:表达小白蛋白的中间神经元通过GABA能输入调节NSC的状态[25],因为这些中间神经元保持GABA的恒定刺激,导致超极化。当这种冲动减少时,神经干细胞自我转化并成为神经祖细胞,随后进一步转化为颗粒细胞并整合海马电路[26]。不同的因素影响神经发生,导致DG和SBZ中的NSC发生星形胶质细胞增生、神经胶质细胞增生和血管重塑[27-28]。
DG的老化使NSC处于更活跃的状态,但却降低了NSCs的增殖,并且使OB对表皮生长因子信号[29]的应答降低。至于NSC的降低,Villeda等在实验中证实,在用老龄小鼠血液接种的幼龄小鼠中,存在一种可导致NSC增殖减少的可溶性分子,如CCL11(又称外毒素)[30]。另一方面,也有证据表明TGF和IL-6的增加产生促炎状态[30]。
神经发生和人类认知功能有不同的机制,包括神经营养因子(BDNF和IGF-1)的增加[31-33],减少细胞周期s期的时间[34,35],防止新神经元的死亡或它们与血管生成[36]的关系。
在影响神经发生[37]的各种因素中,免疫因子在成年期NSC的发生和神经发生中发挥重要作用,特别是白细胞介素-1 (IL-1)[38]、肿瘤坏死因子-α (TNF-α)[39]、白细胞介素-6(IL-6)[40]、干扰素γ (IFN- γ)和白血病抑制因子(LIF)[41-43]。胰岛素样生长因子-1 (IGF-I)是一种由70个氨基酸[44]组成的多肽,通过诱导SVZ和DG神经元的分化、增殖或存活而在正常NSCs中发挥作用[45,46,47]。IGF-I激活rit1等基因,产生ras相关GTPase,增加海马神经干细胞(HNSCs)的增殖[48-50]。此外,它还有助于NSCs向神经元的成熟转化过程,并整合在树突状树[51]中。此外,它有助于神经干细胞向嗅球迁移的SVZ[52,53]。此外,IGF-1的变异如MGF在DG和SVZ[54]中诱导神经发生。
在本世纪初,Fred H. Gage描述了近年来神经科学的一些进展[55-57]。研究发现,大脑在一生中都会发生变化,产生新的神经元和它们与邻近细胞的突触。自我再生和可塑性允许他们在受伤或生病后修复自己,并适应一系列需要额外能力的环境,有可能增强大脑的思考能力(见下文)。使用药物,刺激大脑来取代自己的细胞(神经发生)和重建受损的神经元电路是新观点构成替代旧的神经递质和细胞移植在帕金森病的情况下,亨廷顿氏舞蹈症或脊髓损伤,导致贫穷。此外,这一发现还涉及到成年鸟类、非人类灵长类动物和人类大脑中出现新神经元的现象,这一现象被称为神经发生。他们发现了周期性分裂的全能干细胞,产生其他干细胞、新的神经元、支持细胞或胶质细胞,并预测位于脑室、海马和嗅球。它们是带有各自突触的神经元还是神经胶质细胞,取决于它们到达时大脑的位置以及它们在到达时的活动。从新神经元形成的那一刻起,直到它成为一个能够接收和发送信息的功能性细胞,这需要1个月的时间。神经发生是一个高度受控的复杂过程;神经元或胶质细胞中全能细胞的转化是由大脑神经营养因子和类似胰岛素的因子调控的:脑依赖性神经营养因子(BDNF)使神经元存活; the ciliary neurotropic factor (CNTF) protects neurons from death; neurotropin-3 (NT-3) promotes the formation of oligodendrocytes; GDNF), potentiates the motor neurons to form new branches; epidermal growth factor, EGF, an inducer of the division of brain stem cells and fibroblast growth factor, FGF, in low doses keep alive several types of cells; Glial-2 (GGF-2) stimulates beneficial glial production; Insulin-like Growth Factor - 1, stimulates the birth of neurons and glia cells; FGF and EGF participate in the neurogenesis of the hippocampus to reconstruct the necrotic tissue after vascular accidents; FGT and presenilin increase neurogenesis in Alzheimer to reverse the disease. Fred H. Gage has proposed that the following events occur in neurogenesis: Stem cells are the source of new cells. They are periodically divided into 2 main areas: the ventricles which contain the spinal brain fluid (CSF) and the hippocampus, a crucial structure for learning new information and memory. The hippocampus, by producing new neurons, conditions the formation of connections between existing and new neurons, increasing the brain's ability to process and record
新信息。母细胞增殖产生其他的子母细胞和神经元前体,这些前体中的一些细胞将成为神经元,而另一些则成为支持细胞(星形胶质细胞、少突胶质细胞、胶质细胞)。新形成的子干细胞从它们的祖细胞转移到嗅球,其中50%将分化成神经元细胞。在成年人的大脑中,在海马体和嗅球中发现了新生的神经元。研究人员希望能够诱导大脑自我修复,刺激nsc增殖,神经前体的合成及其随后的成熟和专业化成熟神经元和神经元相互连接的复杂系统,建立几个决定网站,在必要时(6,25岁,32岁,36岁,46岁,则高达55 -]。
成年中枢神经系统的干细胞可以产生新的神经细胞和胶质细胞:从人类胚胎中仅100个细胞中分离出来的胚胎干细胞可以产生身体的任何类型的细胞[6,25,55,56]。这些干细胞可以被培养、繁殖,然后移植到成年动物的中枢神经系统中。它们在海马体和嗅球中成功存活,并分化成成熟的神经元。如果把它们放在另一个地方,它们不会在神经元中分化,而是在胶质细胞中分化。
1979年,使用大鼠脑胎模型进行了使用新标志物,使用新标记的中枢神经系统的开发的第一个描述[61]。使用相同的标记,描述了衍生自干细胞PCC3和PCC4的小鼠畸形瘤中CNS发育的肿瘤模型[62]。在两种模型中获得的结果的比较表明胚胎胎儿发育和肿瘤发育之间存在会聚。AFP是针对恶性CNS肿瘤的完美抗原吗?考虑到AFP不仅存在于胶质中,而且在分化的神经元细胞中存在,这限制了其对胶质和神经元衍生肿瘤的分化诊断和治疗有用。幸运的是,仅在正常或肿瘤发育的胶质细胞中呈现的新癌蛋白,生长因子IGF-I,但是
在神经元细胞中缺失,被认为是治疗目的[63,64]。IGF-I被认为是包括CNS在内的正常和肿瘤发育最重要的生长因子[65]。逻辑上,为了阻止肿瘤的发展,可以使用反义[66-68]或三重螺旋[69,70]技术,考虑在转录或翻译水平上“来源”抑制成胶质母细胞瘤癌细胞中IGF-I的合成。
使用表达反义IGF-I RNA的载体,通过反义方法将IGF-I的翻译水平靶向于胶质瘤恶性细胞[64]。这项技术取得了积极成果在体外,在胶质瘤细胞培养中停止IGF-I的合成在活的有机体内,阻止肿瘤的发展[71]。这种策略在历史上催生了一个新的肿瘤学领域——癌症基因治疗[72]。注射在活的有机体内将转染的抗基因(反义或三重螺旋)抗IGF-1细胞分为携带患有干细胞PCC3和4的畸胎癌肿瘤的动物,或使用还在胶质瘤大鼠肿瘤中使用转染细胞,或应用于胶质母细胞患者的临床治疗,诱导由TCD8 +细胞介导的抗肿瘤免疫应答[71,73-75]。
下面我们举例说明分子生物学应用的效率反基因战略目标IGF-I鼠标畸胎癌模型派生的茎PCC3和PCC4胚胎性癌干细胞(PCC干细胞转染技术使用antisens或三重螺旋向量(73、74)(图1 - 8)。我们需要添加,与转基因PCC干细胞相等的基因,在自然界是不存在的。

图1所示。将干细胞-PCC3胚胎癌细胞注射到129只小鼠体内,形成畸胎瘤结构。(左)被神经上皮细胞包围的神经上皮花环,HE,x250;(中)同一低分化神经上皮花环的高倍放大,x400。(右)神经上皮分化的更高级步骤,显示神经源性囊肿“病理性神经管”。囊肿壁及其邻近区域由相同类型的神经上皮细胞构成。囊肿周围的神经上皮细胞呈现神经脑脊液特征,HE,x250。

图2。与图1所示的两种结构相比,注射干细胞PCC3细胞可导致畸胎瘤,显示囊肿分化的中间步骤(底部向下)。分化的神经室管和成簇排列的细胞群(箭头)用抗AFP抗体、免疫过氧化物酶抗体、x250标记。

图3。畸胎瘤是注射干细胞- PCC3胚胎癌细胞的结果。神经上皮结构的成熟顺序显示分化的步骤:1。在分化;2.低分化(玫瑰);3.中度分化;4.分化良好,未成熟-胚胎形态);5. Well differentiated, immature – fetal form; 6. Well differentiated, mature. End points of AFP staining shows maximum in the steps 3 and 4; AFP is absent in steps 1 and 6.

图4。反义图式和三重螺旋技术抑制生长因子。反义技术的最终结果是通过与反义RNA结合抑制GF mRNA(义RNA)的活性。在GF三螺旋技术中,低聚嘌呤第三链(23bp)与GF基因形成RNA-DNA三螺旋。

图5。IGF-I反义和IGF-I三螺旋技术pMT/EP载体的制备方案。
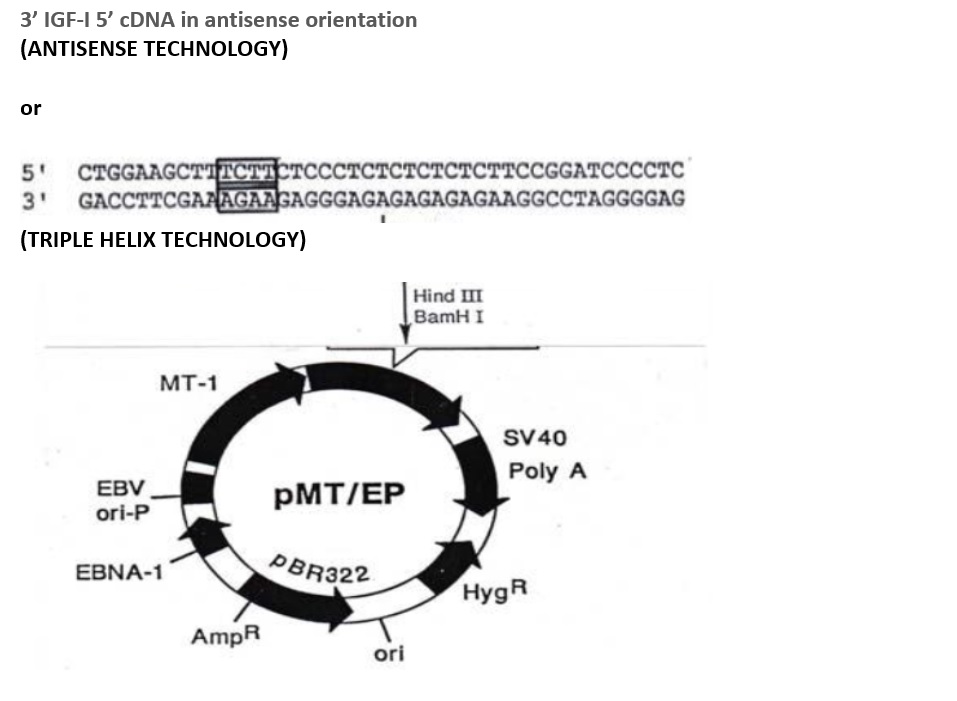
图6。反义和三重螺旋向量的构造。在反义技术中,插入反义方向的cDNA:表达反义IGF-I RNA的episomal载体。在三螺旋技术中,将PCR制备的23bp RNA插入:将23bp RNA与基因组DNA表达,形成三螺旋,具体如下:
Agagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagag
*****************************
AGAAGAGGGAGAGAGAGAAGG
——基因组DNA
TCTTCTCCCTCTCTCTCTCTCC
*** hoogsteen债券
三世沃森克里克债券

图7。免疫基因治疗机制。转染后体外在干细胞- PCC3胚胎癌细胞中,使用Antisens IGF-I载体,细胞停止合成IGF-I,并具有免疫原性,表达MHC-I和B7抗原。一部分细胞进入细胞凋亡,其中抗IGF-I细胞进入细胞凋亡。将这些转染的细胞注射到动物体内,诱导CD8淋巴细胞介导的抗肿瘤免疫应答。(87、93)。缩写:TAP 1,2:与抗原加工相关的转运蛋白);TK:酪氨酸激酶;PI3K:磷脂酰肌醇3激酶;PDK1:磷酸肌苷依赖激酶1;AKT: PKB,蛋白激酶B;Bcl 2:凋亡的关键分子; GSK3: glycogene synthetase kinase 3; GS: glycogene synthetase; PKC: protein kinase C.

图8。(上)129sv小鼠注射表达反义IGF-I RNA的PCC3细胞(左、中)和反义IGF-II细胞(右)造成的病变。(左)淋巴细胞浸润,HE, x80;(中)抗CD8抗体染色序列切片,x80。(右)成熟的表皮样结构,伴一层深色神经上皮细胞,HE, x125。(Down)注射表达PCC3的反义IGF-I诱导的肿瘤消退。(左)转染PCC3细胞后4天的切片显示畸胎瘤,显示胚胎癌细胞(开箭头),神经母细胞呈假莲座状排列(星形),神经系统来源的细胞散在血管周围(断箭头),HE, x110。(中)抗CD8抗体染色序列切片,x110。(右)转染细胞注射后第9天的畸胎瘤,显示胚胎癌细胞和神经母细胞假花环(星形),以及分离和坏死的组织(黑色圆圈),HE, x110。
提出的抗基因(反义或三重螺旋)治疗机制涉及生长因子及其受体(IGF-I, tgf - β, EGF, IGF-I- r, EGF- r) -增加的抗肿瘤免疫反应(CD8 +)的组合,抑制参与肿瘤表型转化的PI3K / AKT / GWK3 / GS信号转导途径[76]。在胶质母细胞瘤中,胶质肿瘤细胞增殖,形成快速生长的肿瘤。这些细胞是如何由调节其分裂的元素诱导的母干细胞产生的,这将是一种有希望的病理现象。
IGF-I被认为在肿瘤发生中起主要作用[65],尤其是在胶质母细胞瘤中[77],胶质母细胞瘤是成人最常见的原发性脑肿瘤,其预后低于1年,只有5-10%的病例低于2年[78]。在该肿瘤以及PCC干细胞衍生的畸胎瘤中,IGF-I和胰岛素通过不同的信号途径增加增殖,促进胶质母细胞瘤的细胞生长[79]。顺便说一句,临床流行病学研究证明胰岛素治疗患者的死亡率增加[80],这是IGF-I信号转导通路在癌症发展的危险因素中起作用的补充数据[79,81]。胶质母细胞瘤患者的血清IGF-I水平较高[82],与正常组织相比,肿瘤组织的IGF-I和胰岛素受体水平升高[83],从而诱导肿瘤细胞的增殖、分化和迁移[83,84]。p53突变诱导IFG-I受体上调的机制,以及出于同样的原因导致癌细胞存活,也可能发挥作用[85]。
新的或提出的胶质母细胞瘤的疗法基于免疫治疗或免疫基因策略[86],包括抑制剂[87],抗基因策略[66-70,88]。最后的方法允许我们建立靶向胶质瘤的生长因素的新的和成功的基因治疗策略,并且现在已经被引入临床试验(患者的中位生存率达到2年,以及某些情况3或4年)[89]。
其他靶向tgf - β或VEGF及其受体及其下游转导信号元件的AS方法[90-92]似乎为一个有希望的解决方案提供了希望。神经肿瘤学学会举办的最近的研究强调关注PI3K / AKT通路的作用在胶质细胞:同时逮捕了至少两个链接或者IGF-I TGFbeta或VEGF和GS,通路的TK / PI3K / AKT / GSK3 / GS(92 - 94)似乎在未来基因治疗临床试验治疗“绿带运动”的策略。
其他最近引进的技术包括可能有用的siRNA[95,96]和miRNA (microRNA)[97]。21-23 mer双链RNA (si RNA)在基因沉默中的作用与TH DNA机制非常相似,TH DNA机制也涉及23 mer RNA[70]。至于mirna,它们可能在肿瘤发生、控制细胞增殖和凋亡中发挥基础性作用;在胶质瘤中,有报道称miRNA (microRNA-21)水平升高[98]。
突触发生在学习和记忆中起着重要的作用。从新形成的子干细胞转移到整合大脑回路中的子细胞,并与现有的子细胞连接,形成突触需要一个月的时间。在突触发生的过程中,一个神经元的树突与另一个神经元的轴突相接触。树突刺的形状在几分钟内就会改变。弗雷德·盖奇在他的文章中告诉我们:“锻炼,身体活动,经验,可以调节大鼠海马体的神经发生,新生干细胞神经元的生存和它们融入现有神经元回路的能力”[56]。Henrieth van Praag已经证明,在一个旋转的环上锻炼的老鼠可以使海马体中分裂的干细胞数量翻倍[99,100]。
关于记忆的机制,科学家们研究能刺激基因产生生长因子的小分子。另一种可能性是使用基因疗法和细胞移植。这些技术可以通过基因操作增加生长因子的细胞产量,然后将这些细胞植入大脑的特定区域。这种可能性需要一个伦理上的考虑:生长因子可能会诱发肿瘤的发展,移植的细胞可能会失去控制。这对阿尔茨海默病患者来说是可以接受的风险,但对健康的人来说则不然。
环境刺激脑室和海马的神经发生,干细胞和神经元前体迁移到嗅球。然后干细胞“旅行”到大脑中突触发生的特定位置,参与产生自我再生和大脑自我修复的可塑性和能力的活动。Ratey告诉我们“衰老是不可避免的,严重的记忆丧失则不是”[101]。有几个因素可以推迟阿尔茨海默氏症和老年性痴呆记忆障碍的发病时间;目前的研究对象包括:摄入维生素E和Celegeline等抗氧化剂,非甾体抗炎药,阿司匹林和布洛芬,维生素b12,摄入肉碱。银杏叶也没有
显示对神经发生有良好的作用,但它可以增加血流量和大脑氧合[16,56,99-106]。
所有作者(SJB, RS, AA, JJR, JT)对手稿的准备工作贡献相同。作者信用的基础是:1)对概念、数据获取和数据解释的重大贡献;2)对文章中重要的知识分子内容进行批判性修改;3)拟出版版本的最终审定;(四)同意作为该工程的担保人
我们要感谢Annabelle Trojan女士(波哥大FUJNC大学)对结果进行了有价值的讨论,并对最后的文本进行了修正。
作者得到了Bogotá ICGT S.A.S.协会(主席J. Trojan)和UNAB布卡拉曼加大学(院长J.J. Rey)的支持。
作者声明他们没有相互竞争的经济或非经济利益。
伊凡痛风
研究文章
收稿日期:2019年1月24日
接受日期:2019年2月13日
发布日期:2019年2月16日
布埃诺SJ©2018。这是一篇开放获取的文章,在知识共享署名许可协议的条款下发布,该协议允许在任何媒体上无限制地使用、发布和复制,前提是注明原作者和来源。
脑干细胞和IGF-I在发育、再生和癌症治疗中的意义。Integr Mol Med 5: DOI: 10.15761/IMM.1000319
弗罗里达布兰卡UNAB大学保健科学系教授,哥伦比亚波哥大莱格兰实验室

图1所示。将干细胞-PCC3胚胎癌细胞注射到129只小鼠体内,形成畸胎瘤结构。(左)被神经上皮细胞包围的神经上皮花环,HE,x250;(中)同一低分化神经上皮花环的高倍放大,x400。(右)神经上皮分化的更高级步骤,显示神经源性囊肿“病理性神经管”。囊肿壁及其邻近区域由相同类型的神经上皮细胞构成。囊肿周围的神经上皮细胞呈现神经脑脊液特征,HE,x250。

图2。与图1所示的两种结构相比,注射干细胞PCC3细胞可导致畸胎瘤,显示囊肿分化的中间步骤(底部向下)。分化的神经室管和成簇排列的细胞群(箭头)用抗AFP抗体、免疫过氧化物酶抗体、x250标记。

图3。畸胎瘤是注射干细胞- PCC3胚胎癌细胞的结果。神经上皮结构的成熟顺序显示分化的步骤:1。在分化;2.低分化(玫瑰);3.中度分化;4.分化良好,未成熟-胚胎形态);5. Well differentiated, immature – fetal form; 6. Well differentiated, mature. End points of AFP staining shows maximum in the steps 3 and 4; AFP is absent in steps 1 and 6.

图4。反义图式和三重螺旋技术抑制生长因子。反义技术的最终结果是通过与反义RNA结合抑制GF mRNA(义RNA)的活性。在GF三螺旋技术中,低聚嘌呤第三链(23bp)与GF基因形成RNA-DNA三螺旋。

图5。IGF-I反义和IGF-I三螺旋技术pMT/EP载体的制备方案。

图6。反义和三重螺旋向量的构造。在反义技术中,插入反义方向的cDNA:表达反义IGF-I RNA的episomal载体。在三螺旋技术中,将PCR制备的23bp RNA插入:将23bp RNA与基因组DNA表达,形成三螺旋,具体如下:
Agagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagagag
*****************************
AGAAGAGGGAGAGAGAGAAGG
——基因组DNA
TCTTCTCCCTCTCTCTCTCTCC
*** hoogsteen债券
三世沃森克里克债券

图7。免疫基因治疗机制。转染后体外在干细胞- PCC3胚胎癌细胞中,使用Antisens IGF-I载体,细胞停止合成IGF-I,并具有免疫原性,表达MHC-I和B7抗原。一部分细胞进入细胞凋亡,其中抗IGF-I细胞进入细胞凋亡。将这些转染的细胞注射到动物体内,诱导CD8淋巴细胞介导的抗肿瘤免疫应答。(87、93)。缩写:TAP 1,2:与抗原加工相关的转运蛋白);TK:酪氨酸激酶;PI3K:磷脂酰肌醇3激酶;PDK1:磷酸肌苷依赖激酶1;AKT: PKB,蛋白激酶B;Bcl 2:凋亡的关键分子; GSK3: glycogene synthetase kinase 3; GS: glycogene synthetase; PKC: protein kinase C.

图8。(上)129sv小鼠注射表达反义IGF-I RNA的PCC3细胞(左、中)和反义IGF-II细胞(右)造成的病变。(左)淋巴细胞浸润,HE, x80;(中)抗CD8抗体染色序列切片,x80。(右)成熟的表皮样结构,伴一层深色神经上皮细胞,HE, x125。(Down)注射表达PCC3的反义IGF-I诱导的肿瘤消退。(左)转染PCC3细胞后4天的切片显示畸胎瘤,显示胚胎癌细胞(开箭头),神经母细胞呈假莲座状排列(星形),神经系统来源的细胞散在血管周围(断箭头),HE, x110。(中)抗CD8抗体染色序列切片,x110。(右)转染细胞注射后第9天的畸胎瘤,显示胚胎癌细胞和神经母细胞假花环(星形),以及分离和坏死的组织(黑色圆圈),HE, x110。