摘要目的:子宫内膜增生是荷尔蒙变化的结果,与生殖晚期和围绝经期卵巢自然衰竭有关。这些患者大部分需要激素治疗,但这种治疗增加了血栓形成(动脉和静脉)的风险,特别是我们的一些患者有隐藏的基因决定的血栓形成。
方法:收集2008年9月至2016年9月子宫内膜增生患者的数据。激素治疗3个月后,深静脉血栓发生率仅为1例。fisher精确检验用于估计高凝状态的存在与血栓形成的遗传决定因素之间的关系。
结论:现代医学的一个有希望的方向是血栓性并发症的早期预防问题,基于对这些凝血状态的仔细研究,并在每一个血栓病病例中确定这些变化的原因,包括凝血和纤溶系统的遗传缺陷的识别。
血栓症,基因多态性,子宫内膜增生,肥胖
子宫内膜增生——是最常见的增殖性疾病之一,发生于生殖期或围绝经期,可能与卵巢功能障碍、子宫肌瘤、子宫内膜异位症、代谢综合征等生殖和躯体疾病有关。在所有妇科疾病中,子宫内膜增生性病变的发生率为18% ~ 23%[1-4]。这种病理通常需要激素治疗。激素治疗可能会增加静脉血栓栓塞的风险,因为血栓症具有遗传性和获得性[5,6]。我们必须注意由于凝血和纤溶系统的遗传缺陷而导致的先天性潜伏性血栓病[7]。
负荷患者的激素治疗使血栓形成(静脉和动脉)和静脉血栓栓塞的风险增加数倍[8,9]。根据一些作者的研究,先天性血栓形成患者的发生率在75% - 80%之间[10,11]。
因此,我们研究的目的是确定子宫内膜增生患者中血栓形成的遗传多态性频率,并与有静脉血栓形成史的患者进行比较。需要本研究来完成对妇科患者尤其是血栓栓塞事件高危患者的最佳治疗的认识。
在这项前瞻性研究中,我们分析了207例患者的综合临床和实验室检查结果。女性被分成三组。研究组95例。本组纳入标准为:形态学确诊为子宫内膜增生伴肥胖(50例)和无肥胖(45例)。对照组包括51例有静脉血栓形成史和血栓后疾病的患者。对照组的排除标准为严重的外阴疾病失代偿。对照组为61名完成生殖功能的健康妇女。全面的临床和实验室检查,包括能够提供止血疾病鉴别诊断的实验室检查(PAI-1活性、APTT、PTT、血小板计数、血小板聚集、止血激活标志物、d -二聚体)。
对F5基因(FV Leiden突变,因子基因编码V)进行基因分型;F2 (G20210A,凝血酶原);MTHFR (C677T, 5,10-亚甲基四氢叶酸还原酶),SERPINE1 (4G / 5G,纤溶酶原激活物抑制剂-1),THBS4 (G1186C,血栓反应蛋白-4),F7 (G10976A,因子VII), ITGA2 (C807T,糖蛋白GpIa), ITGB3 (T1565C,异体抗原PI (A2),糖蛋白GpIIIa),以及ACE (I / D,血管紧张素转换酶)和VKORC1 (1639G > A)[6]。
基因分型的DNA来源为血样,血样采集于含有EDTA的容器中,在-20°C - 80°C保存至提取DNA。采用同种基因实验室(Isogene Lab)的guanidintisionatis和nucleus - absorbent试剂,采用Diatom DNA Prep 200试剂盒从外周血淋巴细胞中分离DNA。有限公司、俄罗斯)。分离的DNA保存在-20°C的冰箱中。使用生物有机化学研究所开发的原始测试系统进行基因分型。Shemyakin和Ovchinnikov基于ras的实时PCR与等位基因特异性探针。
妇女的平均年龄为44.85±7.29岁至57.02±8.27岁,由于样本的特殊性而有所不同,在对照组中,我们纳入绝经后妇女。我们发现,对照组肥胖患者(平均BMI=27.7±4.3)发生频率明显低于研究组(平均BMI=31.33±12.01),这与抽样的特殊性有关。
在主组患者中,18%的患者在治疗前存在高凝性和血管内凝血激活,其原因需要在我们的研究过程中明确。所有患者均接受抗磷脂综合征筛查,但未确诊。
为消除止血遗传缺陷,对患者进行筛查:F5 (FV Leiden,因子V)、F2 (G20210A,凝血酶原)、MTHFR (C677T, MTHFR)、SERPINE1 (4G / 5G, PAI-1)、THBS4 (G1186C,血栓反应蛋白-4)、F7 (G10976A,因子VII)、ITGA2 (C807T, GpIa)、ITGB3 (T1565C,同种异体抗原PI (A2), GpIIIa)、ACE (I / D,血管紧张素转换酶)和VKORC1 (1639G > A)。
40岁以上、未生育、无手术史和激素治疗史的妇女中,FV Leiden多态性占4.21%。尽管FV Leiden突变通常表现在较年轻的年龄,但鉴于该突变在血栓形成的发病机制中的重要意义,其存在不能被忽视。激素治疗可增加血栓栓塞事件的风险在这一组几倍,致命的肺血栓栓塞。FV Leiden多态性在有血栓病史的人群中检出率较高,在子宫内膜增生患者中检出率与一般人群相似。
G20210A凝血酶原基因(F2)多态性等位基因A的携带也是先天性血栓病最常见的原因之一。病理性a等位基因在普通人群中的发生率为4.1%,而在本研究中达到2.27% ~ 4.21%。我们的数据充分反映了一般人群的患病率。这组患者的年龄从42岁到45岁不等,不吸烟,以前没有接受过激素治疗,这就是为什么他们没有血栓病史。这种多态性的存在与血栓栓塞事件的高风险有关,特别是在激素治疗或手术期间。有血栓形成史组发生率明显高于对照组(9.21%)。
5,10-亚甲基四氢叶酸还原酶基因多态性的研究是非常实际的。大量临床研究已经确定血浆同型半胱氨酸升高是心血管疾病的重要危险因素。我们的研究结果显示,有静脉血栓形成史的患者T / T基因型纯合突变的发生率明显高于对照组(13.72%),这与文献数据吻合较好[10]。
我们还计算了静脉血栓形成的风险比,这取决于人群和对照组中不同等位基因的存在。我们可以得出结论,在人群中,血栓形成的风险增加了1.8倍,在子宫内膜增生的女性中,T等位基因携带者的风险增加了2.1倍。
纤溶酶原激活物抑制剂基因编码一种在纤溶酶解调节中起关键作用的蛋白。当PAI-1浓度升高时,纤溶系统的抗凝活性降低,这一过程导致血栓形成的风险增加。
图1和图2为无肥胖的子宫内膜增生女性和血栓患者的基因分型结果。变异基因型4G / 4G患者出现子宫内膜增生的比例为22.44% (n=11),而女性血栓形成的比例为47.06% (n=24),两者差异有统计学意义(χ²=5.28,p=0.0216)。基因型5G / 5G患者中检测到子宫内膜增生和非肥胖的病例占20.0% (n=9),而在有血栓形成的女性中没有发现,这也是结果的可靠性(χ²=11,26,p=0.0008)。杂合变异基因型5G / 4G也会导致血栓并发症,因为它包含主要的4G等位基因。这种变异在没有脂肪代谢受损的子宫内膜增生患者中更常见——55,56% (n=25),而在静脉血栓形成的女性中——52,94% (n=27)。然而,我们发现了显著的加性效应(χ²=11,28,p=0.0008),那么4g等位基因在纯合子或杂合子状态下可能对非肥胖型子宫内膜增生患者有有害影响。
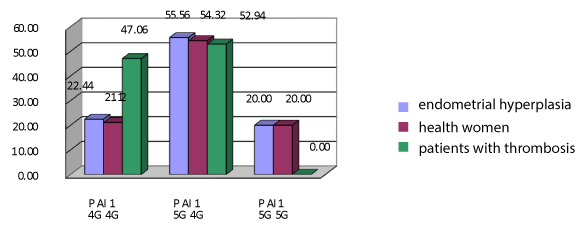
图1所示。子宫内膜增生无肥胖妇女与对照组PAI-1基因多态性的比较。注:*与无肥胖主组比较,差异有显著性p < 0.05。
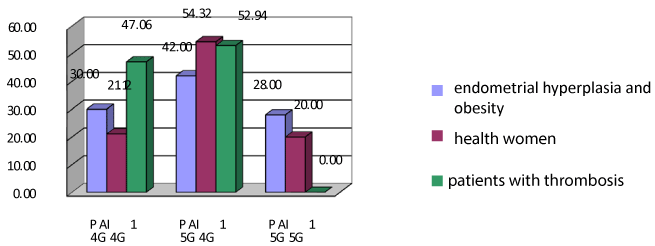
图2。子宫内膜增生和肥胖妇女及对照组PAI-1基因多态性注:*与肥胖主组比较差异有显著性,p < 0.05。
为了确定子宫内膜增生患者血栓形成的风险,根据PAI-1基因不同等位基因的存在,我们计算了该基因不同变异携带者的风险比。在双侧Fisher精确检测中,4G等位基因携带者发生血栓的风险是替代5G等位基因携带者的1.56倍(OR=1,56, df=0,9-2,72)。这一事实表明,子宫内膜增生患者纯合子状态的少量5g等位基因与静脉血栓形成的发生无关。
因此,分析PAI-1的调查结果,我们可以得出结论,无论是否存在代谢综合征,健康女性与子宫内膜增生患者之间的PAI-1无显著差异。
遗传缺陷的因子7基因和酶参与维生素K的转化,影响血栓和出血的风险的频率。这些实施例基因型在一般人群中较为罕见。我们的研究结果也不例外。
版权所有OAT。版权所有
极为有趣的是对G1639A基因VKORC1多态性的研究结果(图3)。双侧Fisher精确检测显示,携带等位基因A的女性发生静脉血栓的风险是携带另一个等位基因G的女性的2.22倍(OR=2,22, df=1,25 - 3,96)。纯合子基因型A / A的存在使静脉血栓形成的风险增加数倍。在这组VKORC1基因为A / A型的患者中,激素治疗3个月后,深静脉血栓的发生率仅为1例。
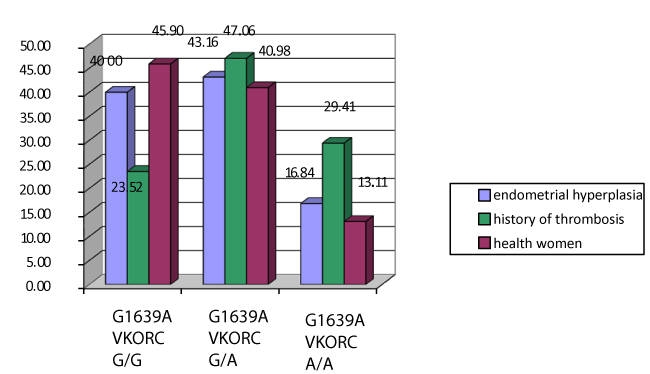
图3。子宫内膜增生女性与对照组VKORC基因G1639A多态性注:*与主组比较,差异显著性为p < 0.05。
因此,纯合子基因型VKORC1是血栓形成的另一个危险因素,在子宫内膜增生和肥胖患者中非常普遍。
因此,对于携带VKORC1基因A / A纯合子基因型并伴有子宫内膜增生的患者,无论是否存在代谢综合征,均应尽量避免激素治疗。
在所有患者中,17例仅发现有止血系统改变,10例有严重的遗传性凝血改变,1例深静脉血栓形成,6例有获得性凝血。其中子宫内膜增生和肥胖组14例。
血栓病是一种遗传性和后天性的多因素疾病。我们注意到在不同类型的治疗,特别是激素或手术之前确定血栓形成的重要性。
有血栓栓塞事件高风险的患者,需要调查止血情况,在血管内凝血(PAI-1活性、APTT、纤维蛋白原水平和d -二聚体升高)的情况下,有必要确定血栓形成的原因:遗传多态性、抗磷脂综合征、高同型半胱氨酸血症等。
因此,分析调查结果,尽管这些妇女可能潜在地增加心血管和血栓栓塞事件的风险,但我们不能排除通过激素治疗降低高雌激素血症可能在这些方面发挥一些有利作用的可能性。但是根据不同的激素制剂,血栓形成的风险可能不同。因此,我们必须高度重视药物治疗子宫内膜增生的方法。
然而,对一般人群进行血栓性疾病筛查是不合理的,因此不建议在此时进行筛查。我们希望我们的发现能激发临床医生对子宫内膜增生和肥胖患者的适当治疗方法和治疗时间的关键讨论。
- 里昂:国际癌症研究机构(2007)激素避孕和绝经后激素治疗。见:国际癌症研究机构评估人类致癌风险工作组(编)。IARC专题论文72: 1 - 660。
- Jadoul P, Donnez J .(2003)胰岛素增敏药物二甲双胍对肥胖少经妇女卵巢功能、卵泡生长和排卵率的影响。Fertil杂志80: 1315 - 1322。
- 戴伦·L·罗伯茨,卡罗琳·迪夫,安德鲁·G·勒内汉(2010)肥胖与癌症风险的生物学机制:新视角。年度审核61: 301 - 316。
- 赖晨,黄海军(2006)激素在子宫内膜增生和子宫内膜癌治疗中的作用。当前观点:妇产科18: 29-34。(Crossref)
- Melnichenko GA, Romantsova TI(2004)肥胖的病理方面。肥胖与新陈代谢1: 3 - 9。
- Ginsburg D(2005)确定止血平衡的新遗传决定因素。J血栓出血3: 1561 - 1568。(Crossref)
- Guyatt GH, Akl EA, Crowther M, Gutterman DD, schu nemann HJ等。(2012)抗血栓治疗和预防血栓形成,执行摘要:第9版美国胸科医师学会循证临床实践指南。胸部141: 7 s-47s。
- 何文强,韩金杰,王建军,王建军(2006)静脉血栓栓塞在血栓性疾病患者中的风险:系统评价。高级实习医师166: 729 - 736。(Crossref)
- Shapiro S, Dinger J(2010)口服含屈螺酮口服避孕药使用者静脉血栓栓塞的风险。J Fam计划生殖保健36: 33。
- Patrushev LI(1998)血栓形成状态与现代诊断方法。俄罗斯医学杂志6: 3。
- 王志强,王志强(2001)肥胖对女性雄激素分泌和不育的影响。ob牧师2: 231 - 238。(Crossref)




