摘要
重复性轻度创伤性脑损伤(r-mTBI)越来越受到研究人员的关注,因为一些研究报道了单次mTBI后的认知功能障碍成为可测量的长期缺陷,如处理速度延迟和记忆功能障碍,在r-mTBI后,促进了r-mTBI可能导致大脑累积损伤的新兴假设,并且在没有细胞死亡的情况下,可能导致认知缺陷最终发展为记忆和学习功能障碍。研究还将r-mTBI与“二次冲击综合征”和慢性创伤性脑病(CTE)联系起来,这些可能是r-mTBI的后果。然而,r-mTBI的潜在损伤机制尚不清楚,对r-mTBI的研究仍处于早期阶段。因此,在本研究中在体外采用单轴拉伸模型研究r-mTBI相关的细胞损伤,以阐明r-mTBI与单一mTBI的病理及损伤后后遗症。进行了3种拉伸实验,包括单加载组,在5 s的应变速率下,以0.1的应变进行1次拉伸1在初始拉伸1 h后再次进行相同拉伸的重复加载组和未进行机械加载的单轴拉伸装置设置和取出的假对照组。结果表明,尽管初始损伤诱导了一定程度的肿胀形成,但第二次拉伸增加了肿胀形成,这证实了与单次损伤相比,r-mTBI引起的细胞损伤量增加大小。此外,通过反复拉伸形成肿胀后,在损伤后24小时检测到细胞没有进展到死亡。这些数据表明,如果受伤的神经元随后受到相同水平的低应变,损伤率显着增加,证实了重复性mTBI加剧创伤性轴索损伤的新假设。
关键字
重复性轻度创伤性脑损伤,脑震荡,冲动劳损,轴突拉伸,轴突肿胀,细胞死亡
背景
直到今天,创伤性脑损伤(TBI)仍然是世界范围内死亡率和发病率的主要原因,使TBI成为一个重大的公共卫生问题[1]。仅在美国,估计每年发生TBI的人数为170万[2-3],而在亚洲,每年有300-400人因TBI住院,而在欧洲国家(23个国家的平均值),每年每10万人中有200-300人因TBI住院[4-6]。此外,这些病例中的大多数被归类为轻度TBI (mTBI)或脑震荡[2,7],尽管名称为“轻度”,但仅在美国就有大约15%的mTBI患者患有持续性认知功能障碍[8]。此外,几项针对专业运动员和军事人员的研究报告称,这些认知功能障碍在“重复性”mTBI (r-mTBI)后成为可测量的长期缺陷,例如处理速度延迟和记忆功能障碍,这有助于新兴的假设,即r-mTBI可能会对大脑造成累积损伤,并且在没有细胞死亡的情况下,可能导致认知缺陷,最终可能发展为记忆和学习功能障碍[9-17]。在人类病例的帮助下,动物模型的研究也显示重复性脑损伤的预后恶化,其中细胞死亡和组织损伤是中度和重度脑损伤的常见后果,而不是mTBI,但mTBI后细胞功能障碍和记忆缺陷是明显的[18-22]。
此外,越来越多的证据表明,mTBI患者患有弥漫性轴索损伤(DAI),这是TBI最常见的病理之一,与事故等创伤事件导致的大脑快速变形、拉伸、惯性力有关。跌倒和攻击导致神经元轴突拉伸[23-27],其中轴突的原发性损伤逐渐发展为继发性级联反应,如神经元变性和轴突细胞骨架断裂[28-31]。考虑到DAI与TBI后的即时意识丧失有关,且多项研究表明mTBI患者的白质异常与DAI一致[32-34],由于受损轴突的表型或生理变化可能影响r-mTBI后的预后,因此DAI在r-mTBI中发挥重要作用,因此很可能存在导致重复损伤易损性的潜在机制。研究还将r-mTBI与“二次冲击综合征”联系起来,即个体在初次脑损伤后出现脑震荡后症状,包括视觉、感觉或运动功能障碍或认知和记忆问题等精神困难,以及在第一次损伤后数天或数周发生第二次脑损伤后,毁灭性的脑肿胀导致半昏迷状态,瞳孔扩大,眼球运动丧失和呼吸衰竭[35]。最近,类似的病理,被称为慢性创伤性脑病(CTE),一种神经退行性脑部疾病,作为r-mTBI的另一个后果,越来越多的人意识到这一点[36-40]。
然而,r-mTBI涉及的潜在损伤机制尚不清楚,对r-mTBI的研究仍处于早期阶段。虽然在活的有机体内模型在宏观和微观水平上对理解病理和生理后遗症做出了重大贡献,通过模拟r-mTBI特定方面的体外研究对解决细胞和亚细胞水平上关于损伤后后遗症和r-mTBI相关的亚致死细胞功能障碍的问题至关重要[41]。
本研究介绍了在体外该模型采用单轴拉伸装置诱导后续损伤,实现r-mTBI的损伤后后遗症。提出了在体外单轴拉伸模型提供了一个可靠的环境来研究细胞功能障碍的机制,并更好地表征单次和重复损伤后的细胞降解和功能障碍。结果表明,每隔1小时拉伸两次的神经突肿胀在拉伸后立即增加,并持续24 h,而拉伸一次的神经突肿胀在拉伸后数小时内短暂增加。然而,在反复受到损伤的培养物中,神经元的神经突显示出损伤的迹象,而这种损伤在一次轻微损伤后并不明显。此外,r-mTBI后未检测到明显的细胞死亡。
这些数据表明,如果受伤的神经元随后受到相同水平的低应变,损伤率显着增加,证实了重复性mTBI加剧创伤性轴索损伤的新假设。
方法
单轴拉伸装置
单轴拉伸装置主要由伺服执行器、测量拉伸位移的线性传感器、测量拉伸载荷的称重传感器和聚二甲基硅氧烷(PDMS)腔室组成,如图1所示。关于设备配置和加载机制的完整描述已经发表[42]。通过拉伸前后的显微镜图像计算培养底物在PDMS室中的格林-拉格朗日应变。每位移0.5 mm至4mm,获得培养基质中心点在拉伸方向上的应变,并绘制在图2A中。在本研究中,将图2B所示的位移史应用于应变为0.10的腔室,应变速率为5s1.应变速率由最大应变除以到达最大应变的时间得到。曲线在前10秒内通过拉伸而站起,在最后10秒内以与站立相同的比例释放而收敛。预计基底上的神经元通过基底被拉伸/压缩,具有类似的变形历史。
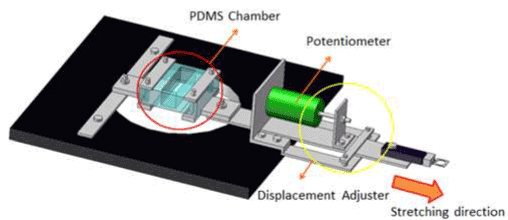
图1所示。单轴拉伸装置。该装置由显微镜台上的PDMS腔室、线性传感器、称重传感器和伺服执行器组成。PDMS腔体的一端固定在显微镜台上,另一端与执行器相连。
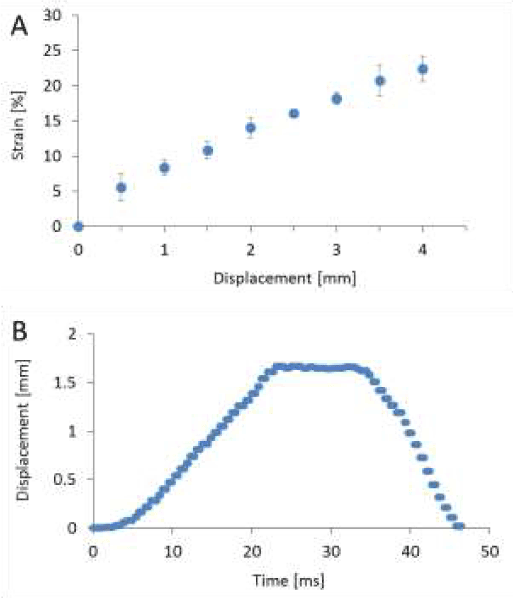
图2。PDMS腔室位移测量。测量了细胞培养中心周围的强迫位移与纵向应变的关系(A)。位移对应的冲击(应变0.10,应变速率5 s-1)表示为时间的函数(B)。
细胞培养
PC12细胞是来源于大鼠肾上腺染色质细胞的肿瘤细胞[43],由RIKEN Cell Bank (Tsukuba, Japan)提供。暴露于神经生长因子(NGF)后,细胞伸展神经突(结构上是轴突状的圆柱形突起),并分化为胆碱能交感神经元[44]。将细胞培养于添加10%胎牛血清(Gibco)、10%马血清(horse serum)、100 U/mL青霉素(Sigma-Aldrich)和0.1 mg/mL链霉素(Sigma-Aldrich)的Dulbecco改良Eagle培养基(Gibco)中,在5% CO的条件下培养2湿度为100%,温度为37°C。将细胞以1500-3000个/cm的速度接种到PDMS腔中2100 ng/mL NGF (Invitrogen)存在5天。作为假对照,在PDMS室中培养年龄与菌株相匹配的神经元,然后将其置于单轴拉伸装置中,并在无机械载荷的情况下取出。实验过程中不需除去PDMS腔内的介质,实验在5 min内完成。保持装置周围温度为37℃。PDMS室被送回CO2实验后的培养箱。
重复拉伸实验
进行了3种拉伸实验。单加载组在5 s应变速率下以0.1的应变进行初始拉伸1重复加载组在第一次拉伸1 h后再次进行相同拉伸,应变为0.1,应变速率为5 s1.假对照组在不接受机械载荷的情况下,将其从单轴拉伸装置中取出。实验过程中不去除PDMS腔内的介质,实验在5 min内完成。实验装置及周围环境温度保持在37℃。PDMS室被送回CO2实验后的培养箱。
形态学观察
使用倒置荧光显微镜(FSX100, Olympus, Tokyo,Japan)观察细胞。在拉伸前和第一次拉伸后5分钟、1小时、3小时、6小时和24小时获得相衬图像。使用ImageJ(美国国立卫生研究院,Bethesda, MD, USA)人工测量神经突的细胞数量和长度。神经突肿胀被定义为神经突中较厚的部分。损伤神经元的定义是神经元有神经突肿胀的比率。
细胞生存能力
使用荧光探针评估细胞活力(LIVE/DEAD viability /Cytotoxicity Assay Kit;Lonza, Walkersville, MD, USA)用于区分活细胞和死细胞。用Dulbecco 's磷酸缓冲盐水(D-PBS)冲洗细胞,用4 μM乙二聚体-1 (EthD-1;激发和发射波长分别为528和617 nm)和2 μM calcein-AM(激发和发射波长分别为494和517 nm),在37°C下放置30 min。用D-PBS冲洗后,使用FSX-100在损伤后24 h获得荧光图像。每个实验随机选取5个区域,人工定量活细胞和死细胞。
统计分析
结果以4个独立实验的均数±标准差(SD)表示。每个PDMS底物共分析100-200个神经元。均数比较采用Steel多重比较检验。一个p值小于0.05为显著性。
结果
拉伸后的PC12细胞出现神经突肿胀(图3);然而,在假手术对照组和拉伸前时间点,它们的数量较少(图4)。拉伸后,单负荷组的神经突肿胀的形成明显增加,并在3小时达到峰值,但在24小时与假手术对照组相比无显著差异。然而,重复负荷组在第二次拉伸后肿胀的形成比第一次拉伸后增加了2倍,并且在所有时间点都明显高于假对照组。
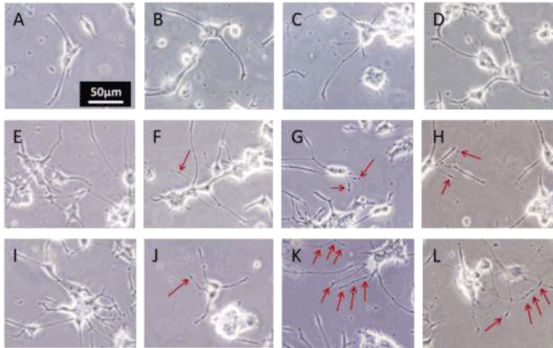
图3。神经突拉伸后的形态变化。相衬图像为假对照PC12细胞(A、B、C和D),分别在预加载(A、E和I)、加载后1 H (B、F和J)、加载后3 H (C、G和K)、加载后24 H (D、H和L)下进行单次拉伸(E、F、G和H)和重复拉伸(I、J、K和L)。比尺为50 μm。箭头表示神经突起肿胀。
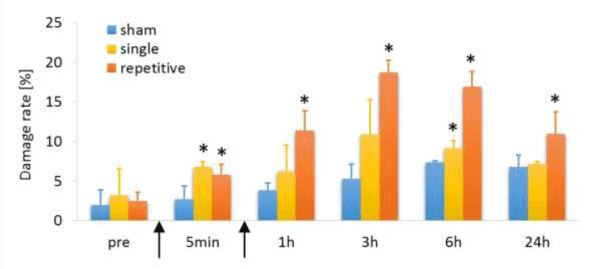
图4。拉伸后损伤率的时间过程。*符号表示在每个时间点与假对照组相比有统计学意义差异(p < 0.05)。箭头表示加载点。
加载后24h的神经突长度、细胞数和细胞存活率见表1。各组间神经突长度和细胞数量无显著差异。虽然各组的细胞活力都没有明显变化,但只有在图5所示的重复加载组中观察到死亡细胞。此外,重复加载组的神经突未被钙黄蛋白- am染色,即使没有肿胀形成。
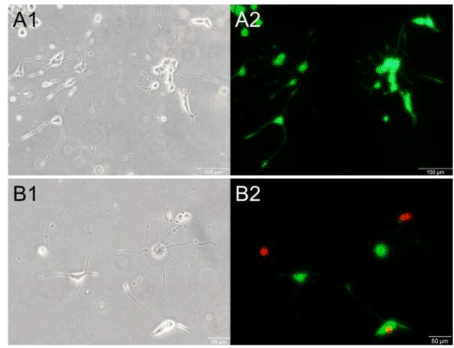
图5。拉伸后的活细胞和死细胞。假手术对照组(A1和A2)、单一加载组(B1和B2)和重复加载组(C1和C2) PC12细胞的相衬图(左)和荧光图(右)。绿色表示活细胞,红色表示死细胞的细胞核。
表1。拉伸后24 h的神经突长度、细胞数量和细胞活力
|
神经突长度[μm] |
细胞数[/mm]2] |
细胞活力[%] |
虚假的控制 |
86±10 |
37±7 |
100±0 |
单一的加载 |
86±4 |
33±1 |
100±0 |
重复加载 |
91±14 |
35±7 |
97.6±3.4 |
|
讨论
重复性轻度创伤性脑损伤(r-mTBI)近年来越来越受到研究者的关注,但多发性mTBI的病理或潜在机制尚不清楚。为了解决文献中的这一空白,一些研究提出了动物模型,其中研究表明,与单一损伤相比,更持久的行为障碍和轴索损伤没有明显的病理损伤或神经元细胞损失,行为缺陷没有明显的神经元损失,神经元细胞骨骼异常,β-淀粉样蛋白沉积加速,并且在第一次TBI后大约持续3至5天的潜在“易损状态”[18-19,21,45-48]。虽然这些在活的有机体内这些研究提供了有价值的信息,有助于理解损伤后行为的变化是可以测量的,并与细胞损伤相关,这些研究的延伸只能达到理论化r-mTBI下细胞水平认知障碍的潜在机制[41]。因此,补充是至关重要的在活的有机体内经过精心设计的研究在体外在细胞水平上研究损伤后的后遗症。
此外,尽管有几个在体外重型、中度和轻度脑外伤引起的轴突损伤模型包括直接轴突横断、加压流体偏转引起的短暂轴突拉伸损伤和单轴轴突拉伸损伤在体外由空气脉冲控制的模型,关注神经细胞的电生理反应、轴突肿胀形成、神经丝结构、离子稳态变化和轴膜渗透性[29,49-62],甚至更少在体外目前对r-mTBI的研究主要集中在损伤间期、病理生理反应、对损伤严重程度的依赖以及细胞降解和功能障碍的表征[41,48,63-64]。因此,在本研究中在体外采用单轴拉伸模型研究r-mTBI相关的细胞损伤,以澄清重复性轻度TBI与单次mTBI的病理及损伤后后遗症。选择单轴拉伸模型是因为轴突的单轴拉伸在临床上比双轴拉伸与轴突损伤的相关性更大[65-67]。此外,广泛采用的涉及流体或空气压力引起的变形的模型是不均匀的,其中假设膜中心的应变作为代表值,这可能导致在将细胞损伤与施加的应变量联系起来时不一致[56]。进行了3种拉伸实验,包括单加载组,在5 s的应变速率下,以0.1的应变进行1次拉伸1在初始拉伸1 h后再次进行相同拉伸的重复加载组和未进行机械加载的单轴拉伸装置设置和取出的假对照组。结果表明,尽管初始损伤诱导了一定程度的肿胀形成,但第二次拉伸增加了肿胀形成,这证实了与相同强度的单次损伤相比,r-mTBI引起的细胞损伤量增加。此外,通过反复拉伸形成肿胀后,在损伤后24小时检测到细胞没有进展到死亡。
综上所述,本研究提出的模型是一种很有前景的方法,可以研究8种损伤的次要途径,结合轴突伸长的方向控制,从而精确控制和观察轴突损伤,损伤对不同细胞类型培养物的影响,r-mTBI的长期后果,以及不同损伤次数和不同损伤间期的影响,这也可以作为本研究的未来工作。
重复性轻度TBI占所有TBI病例的很大一部分,尽管直到近年来对实验性重复性TBI研究的关注仍然很少。然而,最近的研究涉及两者在活的有机体内和在体外研究似乎有希望解释r-mTBI的病理。在彻底认识mTBI后,鉴定特异性mTBI的分子靶点并最终开发新型有效的治疗方法将成为可能。
相互竞争的利益
作者宣称他们没有竞争利益。
作者的贡献
HN设计了这项研究。EK和SS进行拉伸实验,观察细胞形态和活力。SA构思了这项研究,参与了它的设计和协调,并帮助起草了手稿。所有作者都阅读并批准了最终稿件。
致谢
本研究得到日本科学促进会科学研究资助项目(B)(25289064)和科学研究资助项目(C)(26350509)的资助。
参考
- Jennett B(1996)脑损伤的流行病学。[神经外科精神病学]60: 362 - 369。(Crossref)
- 傅立文,徐丽娟,张丽娟(2010)美国外伤性脑损伤:急诊就诊、住院和死亡。疾病预防控制中心,国家伤害预防控制中心。
- 穆松B, Chaytow H, Crynen G, Bachmeier C, Stewart J,等。(2012)重复性轻度创伤性脑损伤小鼠模型的学习和记忆障碍伴组织学改变。J创伤29: 1-13。[Crossref]
- McGregor K, Pentland B(1997)英国脑损伤康复:经济视角。社会科学45: 295 - 303。[Crossref]
- 李建军,李建军,李建军,等(2006)脑损伤流行病学研究进展。神经科学学报(维也纳)148: 255 - 268。(Crossref)
- 王晓明,王晓明,王晓明,等(2013)颅脑损伤流行病学研究进展。Nat Rev Neurol9: 231 - 236。(Crossref)
- Laker SR .(2011)脑震荡与轻度创伤性脑损伤的流行病学。点R3: s354 - 358。(Crossref)
- 国家伤害预防控制中心。《美国轻度创伤性脑损伤:预防严重公共卫生问题的步骤》2003。亚特兰大:疾病控制和预防中心。
- Corsellis JA, Bruton CJ, Freeman-Browne D(1973)拳击的后果。Psychol地中海3: 270 - 303。(Crossref)
- Collins MW, Grindel SH, Lovell MR, Dede DE, Moser DJ等。(1999)大学橄榄球运动员脑震荡与神经心理表现的关系。《美国医学会杂志》282: 964 - 970。[Crossref]
- gukiewicz KM, McCrea M, Marshall SW, Cantu RC, Randolph C等。(2003)大学橄榄球运动员复发性脑震荡的累积效应:NCAA脑震荡研究。《美国医学会杂志》290: 2549 - 2555。[Crossref]
- Iverson GL, Gaetz M, Lovell MR, Collins MW(2004)业余运动员脑震荡的累积效应。神经外科69: 173 - 183。[Crossref]
- (2007)退役职业足球运动员复发性脑震荡与抑郁风险的关系。医学科学运动练习39: 903 - 909。(Crossref)
- Covassin T, Stearne D, Elbin R(2008)大学生运动员脑震荡史与脑震荡后神经认知表现和症状。J运动训练43: 119 - 124。(Crossref)
- Omalu BI, Hamilton RL, Kamboh MI, DeKosky ST, Bailes J(2010)国家足球联赛球员慢性创伤性脑病:病例报告和新出现的医学法律实践问题。J法医护士6: 40-46。
- [j]李建军,李建军,李建军,等(2010)炸弹爆炸对轻度创伤性脑损伤的影响。我njury41: 437 - 443。(Crossref)
- Kamnaksh A, Kovesdi E, Kwon SK, Wingo D, Ahmed F等。(2011)爆炸创伤性脑损伤的影响因素。J创伤28日:2145 - 2153。(Crossref)
- Uryu K, Laurer H, McIntosh T, Praticò D, Martinez D等。(2002)重复性轻度脑损伤在阿尔茨海默淀粉样变性转基因小鼠模型中加速ß沉积、脂质过氧化和认知障碍。J >22日,446 - 454。[Crossref]
- Laurer HL, Bareyre FM, Lee VM, Trojanowski JQ, Longhi L,等。(2001)轻度脑损伤增加大脑对第二次震荡冲击的脆弱性。J Neurosurg95: 859 - 870。(Crossref)
- 李春华,李春华,李春华,等。(2005)重复性轻度脑损伤诱导的神经纤维缠绕形成、脑萎缩和认知缺陷。J创伤22日:1134 - 1141。[Crossref]
- Shitaka Y, Tran HT, Bennett RE, Sanchez L, Levy MA等。(2011)重复性闭颅创伤性脑损伤引起持续性多灶轴突损伤和小胶质细胞反应性。[J]神经病理学杂志70: 551 - 567。[Crossref]
- Fujita M, Wei EP, Povlishock JT(2012)强度和间隔特异性重复性创伤性脑损伤可引起轴突和微血管损伤。J创伤29日:2172 - 2180。(Crossref)
- Smith DH, Meaney DF(2000)创伤性脑损伤的轴突损伤。神经系统科学家6: 483。
- Meythaler JM, Peduzzi JD, Eleftheriou E, Novack TA(2001)当前概念:弥漫性轴索损伤相关的颅脑损伤。物理医学和康复档案82:1461-1471。
- Browne KD,陈晓华,Meaney DF, Smith DH(2011)猪轻度创伤性脑损伤和弥漫性轴索损伤。J创伤28日:1747 - 1755。(Crossref)
- Johnson VE, Stewart W, Smith DH(2012)人类单一创伤性脑损伤多年后广泛存在的Ï”和淀粉样蛋白-β病理。大脑病理学研究22日:142 - 149。(Crossref)
- 刘建军,刘建军,刘建军,等(2013)脑损伤的神经轴突病理学研究。实验神经246: 35-43。(Crossref)
- Stone JR, Okonkwo DO, Dialo AO, Rubin DG, Mutlu LK等。(2004)创伤性脑损伤后不同群体受损轴突中发生轴突运输受损和轴膜通透性改变。实验神经190: 59 - 69。[Crossref]
- Chung RS, Staal JA, Mccormack GH, Dickson TC, Cozens MA等(2005)体外轻度轴突拉伸损伤诱导一系列进行性神经丝改变,最终导致延迟轴突切断术。J创伤22日:1081 - 1091。[Crossref]
- Kelley BJ, Farkas O, Lifshitz J, povlisock JT(2006)创伤性轴索损伤引发超快速继发性轴索切开术和沃勒氏变性。实验神经198: 350 - 360。[Crossref]
- 李建平,李建平,李建平(2007)轻度轴突牵拉损伤后的细胞骨架改变和继发性轴突切开术。Dev一般67: 1831。[Crossref]
- 杨建军,刘建军,刘建军,等。(2005)颅脑创伤后弥漫性轴索损伤的影像学研究。J Neurosurg103: 298 - 303。(Crossref)
- 王晓明,王晓明,王晓明,等(2007)弥散张量成像检测脑损伤后神经轴突损伤的初步研究。J创伤24: 1447 - 1459。[Crossref]
- 王志强,王志强,王志强,等。(2008)青少年急性轻度创伤性脑损伤的弥散张量成像。Neurology70: 948 - 955。(Crossref)
- 坎图RC(1996)运动中的头部损伤。J运动医学30: 289 - 296。(Crossref)
- McKee AC, Cantu RC, Nowinski CJ, Hedley-Whyte ET, Gavett BE等。(2009)运动员慢性外伤性脑病:重复性头部损伤后进行性脑病。[J]神经病理学杂志[68] 709 - 735。[Crossref]
- Gavett BE, Stern RA, McKee AC(2011)慢性创伤性脑病:运动相关脑震荡和次脑震荡脑损伤的潜在晚期效应。临床运动医学30: 179 - 188。(Crossref)
- 李春华,李春华,李春华,等。(2011)慢性创伤性脑病对慢性创伤性脑病的影响。点R3: s460 - 467。[Crossref]
- 张建军,张建军,张建军,张建军(2011)老年人接触性运动相关慢性创伤性脑病的临床研究进展。神经病理学,神经生物学37: 570 - 584。[Crossref]
- Smith DH, Johnson VE, Stewart W(2013)单一和重复创伤性脑损伤的慢性神经病变:痴呆的底物?Nat Rev Neurol9: 211 - 221。(Crossref)
- Slemmer JE, Matser EJ, De Zeeuw CI, Weber JT(2002)反复轻度损伤引起海马细胞累积性损伤。大脑[125]: 2699- 2709。[Crossref]
- 张晓明,张晓明,张晓明,等(2016)大鼠皮层神经元轴突转运功能障碍的研究。整合摩尔医学3: 654 - 660。
- Greene LA, Tischler AS(1976)大鼠肾上腺嗜铬细胞瘤细胞对神经生长因子反应的去肾上腺素能克隆系的建立,美国国家科学院学报73:2424 - 2428。
- Dichter, m.a., Tischler a.s., Greene L.A.。神经生长因子诱导大鼠嗜铬细胞瘤细胞系电兴奋性和乙酰胆碱敏感性的变化。1977.自然268: 501 - 504。
- (1996)重复性轻度脑损伤对细胞骨架蛋白和行为的影响。方法:寻找Exp临床药物18: 105 - 115。(Crossref)
- DeFord SM, Wilson MS, Rice AC, Clausen T, Rice LK等。(2002)反复轻度脑损伤导致B6C3F1小鼠认知功能障碍。J创伤19日:427 - 438。(Crossref)
- 龙吉,李建平,李建平,李建平(2005)重复性实验性颅脑损伤易损性的时间窗。神经外科56: 364 - 374。[Crossref]
- Yuen TJ, Browne KD, Iwata A, Smith DH(2009)轻度轴突损伤引起的钠通道病变加重了重复损伤后的预后。神经科学杂志87: 3620 - 3625。(Crossref)
- Galbraith JA, Thibault LE, mattson DR(1993)乌贼巨大轴突对简单伸长的机械和电响应。生物科技工程115: 13-22。(Crossref)
- Ellis EF, McKinney JS, Willoughby KA, Liang S, povlisshock JT(1995)培养细胞快速拉伸损伤的新模型:星形胶质细胞模型的表征。J创伤12: 325 - 39。[Crossref]
- 张丽,张志强,张志强(1996)Mg2+对机械损伤神经元NMDA电流的抑制作用。科学274: 1921 - 1923。(Crossref)
- Tavalin SJ, Ellis EF, Satin LS(1997)机械损伤或谷氨酸后皮层神经元去极化延迟的电原钠泵抑制。J Neurophysiol77: 632 - 638。(Crossref)
- Smith DH, Wolf JA, Lusardi TA, Lee VM, Meaney DF(1999)培养轴突对动态拉伸损伤的高耐受性和延迟弹性反应。J >19日:4263 - 4269。(Crossref)
- Wolf JA, Stys PK, Lusardi T, Meaney D, Smith DH(2001)外伤性轴突损伤诱导河豚毒素敏感钠通道调节的钙内流。J >21日:1923 - 1930。(Crossref)
- 朱科瑞,赵建平,赵建平(2003)皮层神经元轴突局部横断后轴突萌发的细胞骨架和形态学改变。J >23号:3715。[Crossref]
- Pfister BJ, Weihs TP, Betenbaugh M, Bao G .(2003)轴突损伤的体外单轴拉伸模型。安生物工程31日:589 - 598。(Crossref)
- Geddes-Klein DM, Schiffman KB, Meaney DF(2006)神经拉伸损伤的体外机制和后果与创伤模型不同。J创伤23日:193 - 204。(Crossref)
- 陈玉春,Smith DH, Meaney DF(2009)爆炸致创伤性脑损伤的体外研究。J创伤26日:861 - 876。(Crossref)
- Monnerie H, Tang-Schomer MD, Iwata A, Smith DH, Kim HA等。(2010)动态轴突拉伸损伤后树突的体外改变。实验神经224: 415 - 423。(Crossref)
- Tang-Schomer MD, Johnson VE, Baas PW, Stewart W, Smith DH(2012)创伤性轴索损伤后,微管断裂引起的轴突运输部分中断解释了周期性静脉曲张的形成。实验神经233: 364。[Crossref]
- 李建军,李建军,李建军(2013)机械细胞拉伸诱导神经突生长。Biores开放获取2: 212 - 216。(Crossref)
- Yap YC, Dickson TC, King AE2, Breadmore MC3, Guijt RM4(2014)轻度至极轻度轴突拉伸损伤神经元反应的微流体培养平台研究。Biomicrofluidics8: 044110。(Crossref)
- Slemmer JE, Weber JT(2005)反复损伤培养海马细胞后的损伤程度取决于损伤的严重程度和损伤间期。一般人说18日,421 - 431。[Crossref]
- Weber J T(2007)重复性脑损伤的实验模型。脑研究进展,第16卷,神经创伤:病理学和治疗的新见解,第252-261页。Elsevier, ISBN 978-0- 4444 -53017-2。
- Holbourn AHS(1943)头部损伤力学。《柳叶刀》2: 438 - 441。
- Holbourn(1945)脑损伤的机制。Br Med Bull3: 147 - 149。
- Strich SJ(1961)神经纤维剪切作为头部损伤引起脑损伤的原因。朗缪尔,443 - 448。






