肥胖和糖尿病是目前世界范围内的主要健康问题,而且发病率越来越高。肥胖和糖尿病诱发的继发性疾病具有多种病理生理状态,包括心血管疾病、神经紊乱、肾脏疾病、癌症和骨质疏松症。骨内稳态是通过成骨细胞骨形成和破骨细胞骨吸收之间的微妙平衡来维持的。衰老和多种病理过程诱导成骨细胞骨形成减少,破骨细胞骨吸收增加,导致骨质疏松,骨量减少。成骨细胞和脂肪细胞由骨髓间充质干细胞中的一个共同前体细胞分化而来。1型和肥胖型糖尿病与骨折风险增加有关。营养化学因子可预防糖尿病性骨质疏松症。锌、萨摩、橘子(柑橘unshiuβ-隐黄素和植物成分p-羟基肉桂酸对成骨细胞骨形成有促进作用,对破骨细胞骨吸收有抑制作用,从而增加骨量。这些因素被发现可以改善1型糖尿病的骨质流失在活的有机体内.此外,p-羟基肉桂酸抑制骨髓细胞的脂肪生成体外。这些功能性食物因素可能改善与1型糖尿病和肥胖型糖尿病相关的骨质流失。
肥胖、糖尿病、骨质疏松、脂肪生成、成骨细胞生成、破骨细胞生成、锌、β-隐黄质、p-hydroxycinnamic酸
肥胖和糖尿病是目前世界范围内的主要健康问题,而且发病率越来越高。代谢性疾病的发病率,包括2型糖尿病合并肥胖,已上升到流行水平[1,2]。肥胖和糖尿病可诱发各种病理生理状态的继发性疾病,在心血管疾病、神经紊乱、肾脏疾病、癌症和骨质疏松症等临床方面具有重要意义[3,4]。糖尿病常见于老年人,因此常与骨质疏松症并存。近年来,包括肥胖和肥胖型2型糖尿病在内的代谢性疾病的发病率已上升到流行水平。肥胖和骨质疏松症现在被认为是密切相关的,并有一些共同的特征。体重过轻一直被认为是老年人骨折的危险因素。直到最近,人们才开始关注超重或肥胖人群的骨折。在西方社会,老年人的平均体重急剧增加,亚洲也有类似的趋势。
其中一个共同的特征是,成骨细胞和脂肪细胞是从骨髓中共同的前体细胞间充质干细胞分化而来的[5,6]。间充质干细胞的多能性是众所周知的,其分化成成骨细胞、脂肪细胞、软骨细胞和成肌细胞的能力已被广泛描述[7-14]。间充质干细胞向成骨细胞和脂肪细胞的分化呈反比关系。包括肥胖和糖尿病在内的骨质疏松症与骨髓脂肪有关,骨髓脂肪会大量产生肿瘤坏死因子-α (TNF-α),这是一种炎症细胞因子[15-17]。TNF-α可抑制成骨细胞的发生和矿化[18,19]。
因此,肥胖、糖尿病和骨质疏松症密切相关。在临床方面预防和治疗这些疾病非常重要。我们通过动物模型发现,一些功能性食品化学因子,新型成骨因子,揭示了对与骨质疏松相关的糖尿病条件的改善作用。本文综述了我们在新型成骨因子对1型糖尿病骨质流失的预防作用方面的最新进展。
肥胖是基于对脂肪生成的刺激。骨髓间充质干细胞是多能细胞,在其他细胞谱系中,可产生脂肪细胞和成骨细胞。骨髓间充质干细胞是一种多能基质细胞,在细胞谱系中可分化为成骨细胞(骨细胞)、软骨细胞(软骨细胞)、成肌细胞(心脏细胞)和脂肪细胞(脂肪细胞)等多种细胞类型[5,6]。这是通过复杂信号通路之间的相互作用发生的,这些信号通路包括骨形态形成蛋白(bmp)、无翼型MMTV整合位点(Wnt)蛋白、刺猬蛋白、delta/jagged蛋白、成纤维细胞生长因子、胰岛素、胰岛素样生长因子,以及脂肪细胞和成骨细胞分化的转录调节因子,包括过氧化物酶体增殖物激活受体γ (PPARγ)和runt相关转录因子2 (Runx2)[7-14]。通过进食分泌的胰岛素刺激骨髓间充质干细胞形成脂肪。此外,骨髓脂肪和肥胖的成熟脂肪细胞大量产生肿瘤坏死因子-α (TNF-α),一种炎症细胞因子[17]。这种TNF-α可能导致胰岛素抵抗,从而导致2型糖尿病[21,22]。骨髓间充质干细胞分化可能参与骨质疏松症的发生发展。
骨质疏松症,骨量随着绝经和衰老而急剧减少,也被证明可诱发肥胖、糖尿病(I型和II型)和炎症性疾病[21,22]。1型和2型糖尿病与骨折风险增加有关。骨质疏松和肥胖现在被认为是密切相关的,并有一些共同的特征[5,6]。肥胖伴骨质疏松症的一个共同特征是成骨细胞和脂肪细胞由骨髓间充质干细胞中的一个共同前体细胞分化而来。包括肥胖和糖尿病在内的骨质疏松的次生原因与骨髓脂肪有关,骨髓脂肪会大量产生TNF-α[4,5]。
各种激素和细胞因子,包括瘦素、脂联素、胰岛素、肾上腺素、皮质醇、胰高血糖素、TNF-α和其他因素,是众所周知的与肥胖和糖尿病有关的关键分子。这些因素的干扰可能在肥胖和糖尿病的病理生理条件中起着重要作用。最近,regucalcin,一种细胞内信号系统的抑制蛋白,被认为是肥胖和糖尿病与骨质疏松相关的关键分子[23]。此外,瑞钙素在小鼠骨髓细胞培养中已被证实能刺激脂肪生成在体外[24],表明它作为一种刺激因子参与了脂肪形成。因此,研究结果可能支持骨质疏松症与肥胖和糖尿病有关的观点。
骨骼是一种动态的组织,在脊椎动物的生活中经历不断的适应,以达到和保持骨骼的大小、形状和结构的完整性,并调节矿物质的内稳态。维持骨量的骨内稳态是通过成骨细胞骨形成和破骨细胞骨吸收之间的微妙平衡巧妙调节的[25-27]。成骨细胞由骨髓间充质干细胞分化而来,刺激骨形成和钙化。破骨细胞由造血祖细胞发展而来,促进骨吸收。通过这些骨细胞进行骨转换的生理过程是骨骼系统发育和维持的基础。骨骼重塑和建模是骨骼系统发育和维护的基础[25]。骨造型负责骨的生长和机械诱导适应,它需要骨形成和骨去除(吸收)的过程。骨骼重塑的过程,使骨骼在器官和组织中变得独一无二,并增加了许多层次的复杂性,包括系统影响(激素)、压力作用(体力活动/负重)、骨细胞产生的生长因子和细胞因子或来自骨髓组织中邻近细胞的因子在重塑序列中的相互作用。
许多病理过程都有能力破坏这种平衡,导致骨吸收的速度超过了骨形成的速度,导致骨质疏松症[20]。骨质疏松症是一种以骨密度和骨强度下降和骨微结构恶化为特征的疾病,导致骨折的风险增加。骨质疏松症最显著的表现是股骨近端骨折,其数量随着人口年龄的增长而增加。骨质疏松症是一种常见的代谢性疾病,通常影响老年人和患有其他慢性疾病的人。这在女性中更为常见,绝经后骨量明显减少。绝经后骨量急剧减少,这降低了女性卵巢激素(雌激素)的分泌。雌激素缺乏可促进破骨细胞骨吸收。这对于原发性骨质疏松症非常重要。绝经后骨质疏松症是绝经后女性的典型骨质疏松症,通过复杂多样的代谢和生化变化导致骨质破坏。
骨质疏松症是影响老龄人口的发病率和死亡率增加的主要原因。据估计,全球至少有2亿妇女患有骨质疏松症,其中1 / 3的妇女年龄在60至70岁之间,2 / 3的妇女年龄在80岁以上[28,29]。1995年,美国骨质疏松性骨折的发生率约为150万例,其中75万例椎体骨折,25万例髋部骨折,25万例手腕骨折和25万例其他部位骨折。根据世界卫生组织最近的一份报告,骨质疏松症已成为一个全球性的健康问题,其发病率和死亡率与心血管疾病、糖尿病和癌症相似[3,4]。骨质疏松症被广泛认为是一种主要的公共健康威胁。
高脂肪饮食似乎持续诱导糖耐量受损,葡萄糖水平达到约200 mg/dL[30-32]。C57BL/6J的糖耐量受损,这只小鼠是饮食诱导肥胖的研究最好的模型,似乎是由于胰岛素分泌不良,但胰岛素抵抗也会随着年龄的增长和随之而来的高脂肪饮食的暴露而发展。葡萄糖耐量受损在男性比女性更严重。C57BL/6J小鼠似乎对小梁骨成分[34]有不良影响,最近的证据表明,与骨骼成熟小鼠相比,高脂肪饮食对骨骼未成熟小鼠的影响更明显[35-37]。血清生物标志物和组织光度计显示,骨小梁体积降低主要是破骨细胞吸收增加的结果[35-37],尽管骨形成也减少。有趣的是,最近的数据表明,虽然体重和空腹血糖水平可以在恢复正常饮食后恢复正常,但骨骼成熟前的小梁骨损失可能无法恢复,如果没有一些其他类型的干预[34]。考虑到美国和其他国家的儿童肥胖问题,这些结果的潜在影响是显而易见的。
自发的肥胖ob / ob小鼠是由瘦素基因自发失活突变引起的严重肥胖模型[39,40]。ob / ob小鼠被用作肥胖患者胰岛素抵抗的一般模型。模型中也没有完全的β细胞衰竭,表明糖尿病不是很严重。的重量ob / ob小鼠从2周龄开始迅速增加,体重可达到野生型对照[41]的3倍。暴食症、胰岛素抵抗和高胰岛素血症在3 - 4周龄时都很明显,肥胖在4周龄时很明显。即使在4周时检测到明显的高血糖,血糖水平仍继续升高,直到12 - 20周龄时达到峰值,血糖水平达到400 mg/dL[41]。因为瘦素直接影响骨代谢,骨骼表型ob / ob小鼠并不仅仅归因于观察到的代谢变化。此外,许多研究显示一种复杂的骨骼表型ob / ob腰椎骨小梁质量较高,但长骨骨小梁和皮质骨质量较低[42-44],股骨较短。此外,ob / ob小鼠的生物力学特性(如最大负荷)下降,这是由股骨的三点弯曲所确定的[42-44]。与野生型对照相比,这种小鼠的骨量更低,脊椎动物和长骨的骨形成明显减少,这种不足可以通过瘦素治疗纠正[30,42 -45]。
TallyHo小鼠是早发、自然发生的2型糖尿病和肥胖的多基因模型[30,46]。遗传背景是混合的,但与SWR小鼠有86%的同源性。TallyHo小鼠在4周龄时比对照组更胖,体重也更重[47,48]。体重随着年龄的增长继续增加,但这些小鼠的肥胖比其他一些糖尿病模型要轻。血浆甘油三酯、胆固醇和脂肪酸水平从4到8周龄[49]明显增加。糖尿病只存在于雄性小鼠[47]中。TallyHo小鼠的其他特征包括胰岛肿大、高瘦素血症和伤口愈合不良[48,49]。TallyHo小鼠的骨骼表型研究使用了两种不同的对照菌株[47,50]。赢得了等.使用C57BL/6J小鼠显示雄性TallyHo在8周龄和12周龄[47]时BMD降低。与C57BL/6J[50]相比,TallyHo血清骨钙素降低,骨髓细胞中成骨基因表达模式降低,破骨基因表达模式升高。Devlin等研究结果显示,尽管雄性TallyHo小鼠体重较大,但其总骨密度降低,股骨远端小梁体积最低。股骨三点弯曲显示,雄性TallyHo小鼠的最大负荷高于SWR对照组[50],但其后场变形较小。
如上所述,越来越多的证据表明,肥胖和2型糖尿病的动物模型会诱发异常和骨质流失。因此,骨质疏松症与肥胖和糖尿病有关。
抗再吸收剂已被用于改善骨质疏松的骨质流失的临床护理的首选标准。然而,刺激骨形成的临床化合物仍在开发中。从食物因子中提取的生物活性化学物质合成的新型类似物可能被开发为新药,显示出对治疗包括炎症、肥胖和糖尿病在内的各种疾病诱导的骨溶解的强大成骨作用。以骨髓间充质干细胞分化为靶点的成骨因子的开发在生物医学治疗骨质疏松症中具有重要意义。我们发现了新的成骨因子包括锌化合物、萨摩马、橘子(柑橘unshiuβ-隐黄素和植物成分对羟基肉桂酸如图1所示。研究发现,这些因素对1型糖尿病动物模型中诱发的糖尿病状况和骨质流失具有预防作用。
营养锌的作用:营养锌有促进成骨细胞形成和抑制破骨细胞骨吸收的作用在体外而且在活的有机体内[51]。我们发现醋酸锌对骨具有潜在的合成代谢作用,可防止链脲佐菌素(STZ)诱导的1型糖尿病模型大鼠骨质流失[52,53]。大鼠单次皮下给药STZ (60 mg/kg体重)后,每日口服1次醋酸锌(25、50、100 mg/kg),连续7、14、21 d。STZ致股骨干骺端组织骨丢失如图2所示。服用STZ后,血清葡萄糖、甘油三酯和钙浓度显著升高,体重、血清锌和无机磷浓度显著降低[52,53]。此外,糖尿病大鼠股骨干和干骺端的组织中钙含量、碱性磷酸酶活性和脱氧核糖核酸(DNA)含量均显著降低[52,53]。stz型糖尿病大鼠口服醋酸锌后,这些血清和骨成分的变化有所改善。服用醋酸锌7天[53]也观察到了这种预防效果。本研究证明口服醋酸锌对1型糖尿病患者的糖尿病状况和骨质流失有预防作用在活的有机体内.
β的影响玉米黄质:β-隐黄质,一种类胡萝卜素,已被证明能刺激成骨细胞骨形成和抑制破骨细胞骨吸收在体外而且在活的有机体内[54]。在stz治疗的1型糖尿病大鼠[55]动物模型中发现β-隐黄质可防止骨质流失。STZ单次皮下给药(60 mg/kg体重)后,口服β隐黄素(50或100 μg /kg体重),每日1次,连续7 ~ 14 d。服用STZ后,体重显著下降,血糖、甘油三酯和钙浓度显著升高,显示糖尿病状态[55]。这些改变被β-隐黄素治疗14天所阻止。正常大鼠口服β-隐黄质14天对体重、血糖、甘油三酯和钙浓度[55]无显著影响。stz型糖尿病大鼠[55]的股骨干和干骺端组织中钙含量、碱性磷酸酶活性和DNA含量均显著降低。β-隐黄素(50或100 μg/kg)连续14 d可显著抑制上述下降。正常大鼠给予β-隐黄质14 d后,股骨干和干骺端组织[55]的钙含量、碱性磷酸酶活性和DNA含量显著增加。由此可见,β-隐黄质对1型糖尿病模型大鼠的糖尿病状况和骨质流失具有预防作用。
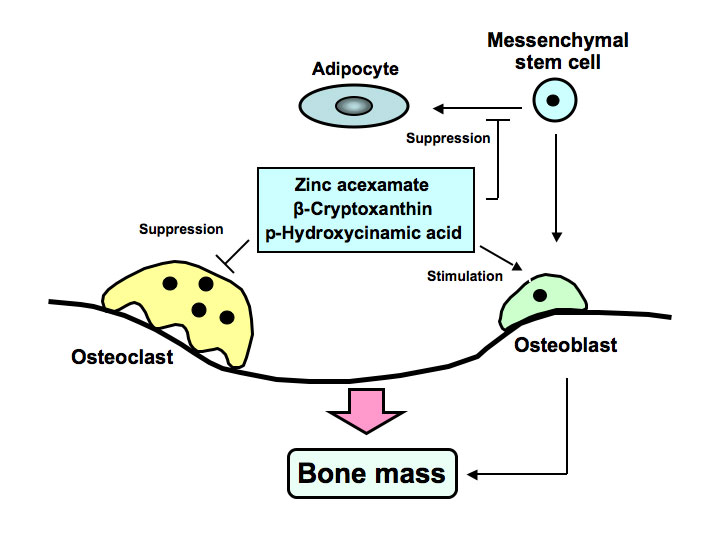
图1所示。乙酸锌、β-隐黄质和对羟基肉桂酸(HCA)刺激成骨细胞骨形成,抑制破骨素骨吸收,从而增加骨量。在1型糖尿病动物模型中发现这些因子可防止骨质流失。研究发现HCA可抑制骨髓间充质干细胞的脂肪生成,提示其具有预防肥胖的作用。
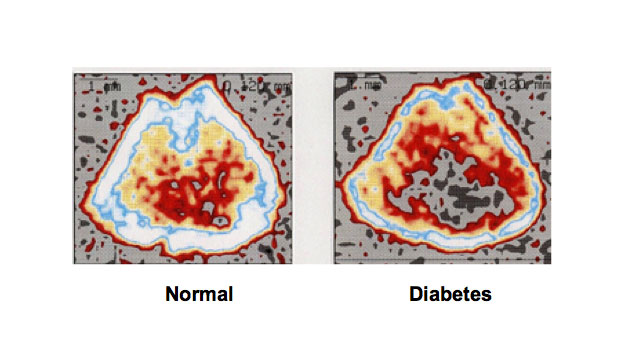
图2。在1型糖尿病动物模型中诱导骨质流失。大鼠皮下注射STZ (60 mg/kg体重)诱导1型糖尿病,21 d后处死。用链脲佐菌素治疗1型糖尿病的大鼠股骨干骺端组织的骨密度显著降低。采用周围定量计算机断层扫描分析骨密度。
对羟基肉桂酸的作用:肉桂酸是一种类黄酮,存在于许多植物和水果中。黄酮对羟基肉桂酸是植物和水果中的一种中间代谢物质,是由酪氨酸合成的。在肉桂酸及其相关化合物(肉桂酸、对羟基肉桂酸、阿魏酸、咖啡酸和3,4 -二甲氧基肉桂酸)中,对羟基肉桂酸已被证明对骨骼有特定的合成代谢作用在体外[56]。对羟基肉桂酸可促进成骨细胞骨形成,抑制破骨细胞骨吸收在体外(57, 58)。口服对羟基肉桂酸对STZ诱导的1型糖尿病大鼠高血糖、高血脂和骨丢失具有预防和修复作用在活的有机体内[59],表明该因子对糖尿病状态具有预防和恢复作用。大鼠先单次皮下给药STZ (60 mg/kg体重),然后口服对羟基肉桂酸(2.5、5、10 mg/kg体重),每日1次,连续14天。STZ给药后体重显著下降,血糖、甘油三酯和钙水平显著升高,提示糖尿病状态。这些改变被对羟基肉桂酸[59]所阻止。stz型糖尿病大鼠[59]的股骨干和干骺端组织中的钙含量显著降低。在给药对羟基肉桂酸[59]后,这种下降被阻止了。stz型糖尿病大鼠[59]的干骺端组织中碱性磷酸酶活性和DNA含量降低。对羟基肉桂酸[59]可阻止stz型糖尿病大鼠的上述降低。因此,我们发现对羟基肉桂酸的摄入对1型糖尿病模型动物的骨质流失具有预防作用,并对糖尿病状态下的血清生化结果具有部分抑制作用。
有趣的是,在小鼠骨髓细胞和小鼠3T3-L1前脂肪细胞培养系统中,发现对羟基肉桂酸可刺激成骨细胞的形成并抑制脂肪生成在体外[60]。生物活性黄酮对羟基肉桂酸是一种新型的成骨因子,可能对肥胖型2型糖尿病相关的骨质疏松症具有预防和治疗作用。
肥胖和糖尿病诱发的继发性疾病具有多种病理生理状态,在心血管疾病、神经紊乱、肾脏疾病、癌症和骨质疏松等临床方面具有重要意义。糖尿病常见于老年人,因此常与骨质疏松症并存。人们对改善与肥胖和糖尿病有关的骨质疏松症的药物了解甚少。此外,刺激骨形成的临床化合物正在开发中。从食物因子中提取的生物活性化学物质合成的新型类似物可能被开发为新药,显示出对治疗包括炎症、肥胖和糖尿病在内的各种疾病诱导的骨溶解的强大成骨作用。以骨髓间充质干细胞分化为靶点的成骨因子的开发在肥胖症、糖尿病和骨质疏松症的治疗中具有重要意义。
我们发现,1型糖尿病患者摄入锌化合物、β-隐黄质和对羟基肉桂酸等新型成骨因子可改善糖尿病状态和骨丢失。这些因素可能是预防和改善糖尿病性骨质疏松症的有用工具,有望在临床方面作为新药的开发。
- 1.Leslie WD, Rubin MR, Schwartz AV, Kanis JA(2012) 2型糖尿病与骨。J骨矿工保留区27日:2231 - 2237。(Crossref)
- 2.Nielson CM, Srikanth P, Orwoll ES(2012)男性和女性的肥胖和骨折:流行病学视角。J骨矿工保留区27日:1 - 10。(Crossref)
- 3.Walker-Bone K(2012)继发性骨质疏松症的识别和治疗。Nat Rheumatol牧师。28日:480 - 492。(Crossref)
- 4.Weilbaecher KN, Guise TA, McCauley LK(2011)骨癌:致命的吸引力。Nat牧师癌症11: 411 - 425。(Crossref)
- 5.王晓燕,王晓燕,王晓燕(2001)间充质干细胞。实验医学杂志(梅伍德)226:507 - 520。(Crossref)
- 6.Muruganandan S, Roman AA, Sinal CJ(2009)骨髓来源间充质干细胞的脂肪细胞分化:与成骨细胞程序的交叉交流。细胞分子生命科学66: 236 - 253。(Crossref)
- 7.Laudes M (2011) WNT信号在确定人间充质干细胞转化为前脂肪细胞中的作用。J摩尔性46: r65 - 72。(Crossref)
- 8.Gharibi B, Abraham AA, Ham J, Evans BA(2011)腺苷受体亚型表达和激活影响间充质干细胞向成骨细胞和脂肪细胞的分化。J骨矿工保留区26日:2112 - 2124。(Crossref)
- 9.Kawai M, Rosen CJ (2010) PPARγ:脂肪形成和成骨的昼夜转录因子。Nat牧师性6: 629 - 636。(Crossref)
- 10.吴丽,蔡鑫,董宏,景伟,黄燕,等(2010)血清通过MEK/ erk依赖性PPARgamma表达和磷酸化调节间充质干细胞的成脂。细胞分子医学14: 922 - 932。(Crossref)
- 11.Laudes M (2011) WNT信号在确定人间充质干细胞转化为前脂肪细胞中的作用。J摩尔性46: r65 - 72。(Crossref)
- 12.Gharibi B, Abraham AA, Ham J, Evans BA(2011)腺苷受体亚型表达和激活影响间充质干细胞向成骨细胞和脂肪细胞的分化。J骨矿工保留区26日:2112 - 2124。(Crossref)
- 13.Kawai M, Rosen CJ (2010) PPARγ:脂肪形成和成骨的昼夜转录因子。Nat牧师性6: 629 - 636。(Crossref)
- 14.吴丽,蔡鑫,董宏,景伟,黄燕,等(2010)血清通过MEK/ erk依赖性PPARgamma表达和磷酸化调节间充质干细胞的成脂。细胞分子医学14: 922 - 932。(Crossref)
- 15.Parhami F, Tintut Y, Beamer WG, Gharavi N, Goodman W,等(2001)致动脉粥样化高脂肪饮食降低小鼠骨矿化。J骨矿工保留区16: 182 - 188。(Crossref)
- 16.Pirih F, Lu J, Ye F, Bezouglaia O, Atti E,等。(2012)高脂血症对骨再生和强度的不良影响。J骨矿工保留区27日:309 - 318。(Crossref)
- 17.Cortez M, Carmo LS, Rogero MM, Borelli P, Fock RA(2013)高脂肪饮食通过增加骨髓间充质干细胞中的NF-κB和减弱PPAR-γ表达,增加IL-1、IL-6和TNF-α的产生。炎症36: 379 - 386。(Crossref)
- 18.李颖,李安,Strait K,张宏,Nanes MS,等。(2007)内源性TNFalpha降低最大骨量峰值,通过NF-kappaB抑制成骨细胞Smad激活。J骨矿工保留区22日:646 - 655。(Crossref)
- 19.常健,王铮,唐娥,范铮,McCauley L,等(2009)核因子kappab对成骨细胞骨形成的抑制作用。Nat地中海15: 682 - 689。(Crossref)
- 20.Weitzmann MN, Pacifici R(2006)雌激素缺乏和骨丢失:一个炎症故事。中国投资116: 1186 - 1194。(Crossref)
- 21.Rossmeisl M, Rim JS, Koza RA, Kozak LP(2003)易受饮食诱导肥胖影响的小鼠品系中2型糖尿病相关性状的变异。糖尿病52: 1958 - 1966。(Crossref)
- 22.Ables GP, Perrone CE, Orentreich D, Orentreich N(2012)蛋氨酸限制性C57BL/6J小鼠对饮食诱导的肥胖和胰岛素抵抗具有抵抗性,但骨密度低。《公共科学图书馆•综合》7: e51357。(Crossref)
- 23.Yamaguchi M(2010)雷钙素与代谢紊乱:雷钙素转基因大鼠诱导骨质疏松和高脂血症。摩尔细胞生物化学341: 119 - 133。(Crossref)
- 24.Yamaguchi M, Weitzmann MN, Baile CA, Murata T(2012)外源性雷钙素在小鼠骨髓培养中抑制成骨细胞形成并刺激脂肪生成。中国医学杂志(综眼)4:1215 - 1222。(Crossref)
- 25.Raggatt LJ, Partridge NC(2010)骨重塑的细胞和分子机制。J临床生物化学285: 25103 - 25108。(Crossref)
- 26.Chambers TJ, Fuller K(2011)破骨细胞是如何诱导骨吸收的?Ann N Y科学学院1240: 1 - 6。(Crossref)
- 27.陈刚,邓超,李一萍(2012)TGF-β和BMP信号在成骨细胞分化和骨形成中的作用。国际生物科学8: 272 - 288。(Crossref)
- 28.Johnell O, Kanis JA(2006)全球骨质疏松性骨折患病率和致残率的估计。现代康复17: 1726 - 1733。(Crossref)
- 29.Davidge Pitts CJ, Kearns AE(2011)不良骨骼影响药物的最新进展。梅奥中国Proc86: 338 - 343。(Crossref)
- 30.Fajardo RJ, Karim L, Calley VI, Bouxsein ML(2014) 2型糖尿病骨骼脆弱的啮齿类动物模型综述。J骨矿工保留区29日:1025 - 1040。(Crossref)
- 31.Rossmeisl M, Rim JS, Koza RA, Kozak LP(2003)易受饮食诱导肥胖影响的小鼠品系中2型糖尿病相关性状的变异。糖尿病52: 1958 - 1966。(Crossref)
- 32.Ables GP, Perrone2021版权所有。蛋氨酸限制C57BL/6J小鼠对饮食诱导的肥胖和胰岛素抵抗具有抵抗性,但骨密度低。《公共科学图书馆•综合》7: e51357。(Crossref)
- 33.Ahrén B, Pacini G(2002)在葡萄糖不耐受小鼠中,胰岛对胰岛素抵抗的补偿不足与葡萄糖有效性降低。J Physiol Endocrinol Metab283: e738 - 744。(Crossref)
- 34.Ionova-Martin SS, Do SH, Barth HD, Szadkowska M, Porter AE,等。(2010)高脂肪饮食诱导的肥胖降低了皮质骨的尺寸无关力学特性。骨46: 217 - 225。(Crossref)
- 35.曹俊杰,Gregoire BR,高红(2009)高脂饮食可降低小鼠胫骨松质骨量,但对胫骨皮质骨量无影响。骨44: 1097 - 1104。(Crossref)
- 36.Halade GV, Rahman MM, Williams PJ, Fernandes G(2010)高脂肪饮食诱导的年龄相关性肥胖和骨质疏松动物模型。J减轻生物化学21日:1162 - 1169。(Crossref)
- 37.Patsch JM, Kiefer FW, Varga P, Pail P, Rauner M,等(2011)短期和长期高脂饮食诱导的肥胖中骨吸收增加和骨微结构受损。新陈代谢60: 243 - 249。(Crossref)
- 38.Baek K, Hwang HR, Park HJ, Kwon A, Qadir AS, et. (2014) TNF-α上调高脂饮食喂养的肥胖小鼠的硬化蛋白表达。J细胞杂志229: 640 - 650。(Crossref)
- 39.瘦素何时成为一种生殖激素?地中海Semin天线转换开关20: 89 - 92。(Crossref)
- 40.肥胖与糖尿病:在小鼠中引起糖尿病-肥胖综合征的两个突变基因。Diabetologia14: 141 - 148。(Crossref)
- 41.Lindström P(2007)肥胖-高血糖小鼠的生理学[ob/ob小鼠]。科学世界杂志7: 666 - 685。(Crossref)
- 42.Ducy P, Amling M, Takeda S, Priemel M, Schilling AF,等(2000)瘦素通过下丘脑中继抑制骨形成:骨量的中心控制。细胞100: 197 - 207。(Crossref)
- 43.Ealey KN, Fonseca D, Archer MC, Ward WE(2006)青春期瘦素缺乏小鼠的骨异常。Regul Pept136:卖地。(Crossref)
- 44.Hamrick MW, Pennington C, Newton D, Xie D, Isales C(2004)瘦素缺乏在肢体和脊柱的骨骼中产生截然不同的表型。骨34: 376 - 383。(Crossref)
- 45.Turner RT, Kalra SP, Wong CP, Philbrick KA, Lindenmaier LB,等(2013)外周瘦素调节骨形成。J骨矿工保留区28: 22-34。(Crossref)
- 46.Kim JH, Stewart TP, Zhang W, Kim HY, Nishina PM,等(2005)2型糖尿病小鼠模型TallyHo在6号染色体上携带肥胖基因,该基因会夸大饮食肥胖。杂志基因组学22日:171 - 181。(Crossref)
- 47.Won HY, Lee JA, Park ZS, Song JS, Kim HY,等(2011)TallyHo/JngJ小鼠中由RANKL和CD4+ T细胞产生的IL-17介导的显著骨丢失。《公共科学图书馆•综合》6: e18168。(Crossref)
- 48.Kim JH, Saxton AM (2012) TALLYHO小鼠作为人类2型糖尿病的模型。方法杂志933: 75 - 87。(Crossref)
- 49.Kim JH, Stewart TP, Soltani-Bejnood M, Wang L, Fortuna JM,等。(2006)TALLYHO/JngJ小鼠多基因2型糖尿病的表型表征。J性191: 437 - 446。(Crossref)
- 50.Devlin M, Vliet MV, Motyl K, Karim L, Brooks D,等(2014)早发型2型糖尿病损害雄性TALLYHO/JngJ小鼠的骨骼获取。内分泌学。(Crossref)
- 51.Yamaguchi M(2010)营养锌在预防骨质疏松中的作用。摩尔细胞生物化学338: 241 - 254。(Crossref)
- 52.Uchiyama S, Yamaguchi M(2003)醋酸锌可恢复链脲佐菌素糖尿病大鼠血清和骨成分的改变。Int J Mol医学12: 949 - 954。(Crossref)
- 53.Yamaguchi M, Uchiyama S(2003)醋酸锌对链脲佐菌素糖尿病大鼠的预防作用:骨丢失的恢复。Int J Mol医学12: 755 - 761。(Crossref)
- 54.Yamaguchi M(2012)类胡萝卜素β-隐黄质在骨稳态中的作用。J生物医学科学19: 36。(Crossref)
- 55.Uchiyama S, Yamaguchi M(2005)口服β隐黄质可在体内预防链脲佐菌素糖尿病大鼠的骨丢失。生物制药公牛28:1766-1769。(Crossref)
- 56.Lai YL, Yamaguchi M(2006)植物成分对羟基肉桂酸在体外刺激大鼠股骨组织骨形成并抑制骨吸收。分子细胞生物化学292:45-52。(Crossref)
- 57.Yamaguchi M, Lai YL, Uchiyama S, Nakagawa T(2008)植物成分对羟基肉桂酸刺激成骨细胞MC3T3-E1的矿化。中华医学杂志22:287-291。(Crossref)
- 58.赖玉玲,山口明(2007)植物成分对羟基肉桂酸抑制小鼠骨髓破骨细胞样细胞形成。中华医学杂志19:123-128。(Crossref)
- 59.Yamaguchi M, Uchiyama S, Lai YL(2007)口服植物成分对羟基肉桂酸对链脲佐菌素诱导的糖尿病大鼠骨质流失有预防作用。中华医学杂志19:803-807。(Crossref)
- 60.Yamaguchi M, Baile CA, Zhu S, Shoji M(2013)生物活性黄酮对羟基肉桂酸在骨髓培养中刺激成骨细胞形成并抑制脂肪生成。细胞组织Res 354: 743-750。(Crossref)



