中耳炎(OM)是儿童最常见的细菌感染,常导致传导性听力丧失。革兰氏阴性细菌病原体,无法分型流感嗜血杆菌(NTHi)是主要致病因子之一。nthi诱发的OM的典型特征是中耳炎症。虽然适当的炎症反应对宿主防御至关重要,但过度的反应往往对宿主有害。因此,必须严格控制炎症。本研究发现,NTHi通过MEK-ERK信号通路上调人中耳上皮细胞中主要促炎介质之一粒细胞巨噬细胞集落刺激因子(GM-CSF)的表达。此外,camp依赖性蛋白激酶A (PKA)通过抑制MEK-ERK信号通路负调控nthi诱导的GM-CSF表达。总的来说,我们的研究揭示了一种新的机制,通过cAMP-PKA和MEK-ERK通路之间的负交叉对话,严格调控GM-CSF的表达,并可能为开发新的抗炎策略提供线索。
不可分型流感嗜血杆菌,GM-CSF,阴性调控,ERK, PKA
中耳炎是小儿最常见的感染性疾病。由于该病往往在言语和语言发育的关键时期导致传导性听力损失,因此OM患儿可能存在言语和语言障碍[1,2]。Nontypeable流感嗜血杆菌(NTHi)是引起OM[3]最常见的革兰氏阴性细菌病原体之一。抗生素常用于OM的治疗。然而,不适当的抗生素治疗明显导致耐多药菌株的增加[4,5]。因此,在了解OM的分子发病机制的基础上,需要开发新的治疗策略。
由细菌感染引起的过度炎症是OM的标志,其特征是促炎介质上调[6,7]。炎症在宿主对细菌的防御中起着重要的作用。然而,如果不加以控制,过度炎症往往会造成组织损伤和OM等免疫病理[8,9]。因此,必须严格控制炎症。在多种促炎介质中,粒细胞巨噬细胞集落刺激因子(GM-CSF)在刺激粒细胞和巨噬细胞从祖细胞增殖和分化中起关键作用,是宿主应答感染[10]的重要促炎介质。在gm - csf缺陷小鼠[11]中观察到脂多糖(LPS)诱导的炎症抑制。与这一发现一致的是,在LPS和肿瘤坏死因子-α (TNF-α)[12]的作用下,小鼠使用GM-CSF可增强促炎细胞因子的上调。OM患者[13]中耳积液中可检出GM-CSF。然而,NTHi对GM-CSF诱导的严格调控的分子机制仍然是未知的。了解nthi诱导的GM-CSF在中耳表达的调控机制可能有助于开发新的OM治疗策略。
环磷酸腺苷(cAMP)是一种第二信使,已被证明可以调节炎症和免疫反应[14-18]。前期研究表明,cAMP通过一个主要的下游效应蛋白激酶a (PKA)[15]调控多个信号通路。在lps处理的巨噬细胞中,细胞内cAMP水平的升高导致促炎细胞因子如TNF-α和IL-1β的抑制[19-21]。因此,激活cAMP信号可能是一种有趣的抑制炎症的治疗策略。事实上,通过使用磷酸二酯酶4B (PDE4B)抑制剂罗氟米司特增加细胞内cAMP已被批准用于治疗严重慢性阻塞性肺疾病(COPD)[22]。camp依赖的PKA信号通路在nthi诱导的中耳GM-CSF表达中的作用尚不清楚。
在本研究中,我们研究了cAMP- PKA通路在nthi诱导的人中耳上皮细胞GM-CSF表达中的作用及其分子机制。我们发现NTHi通过MEK-ERK信号通路诱导GM-CSF表达。我们进一步发现,cAMP的升高通过抑制ERK的激活来抑制nthi诱导的GM-CSF的表达。此外,我们还发现camp依赖的PKA参与了nthi诱导的GM-CSF表达的负调控。因此,我们的研究首次提供了NTHi通过camp依赖的PKA信号通路负调控GM-CSF诱导的直接证据,可能有助于开发新的抗炎治疗策略。
试剂和抗体
PD98059、U0126、forskolin、H89购自Enzo Life Sciences。N6-Phenyl-cAMP (6-Phe-cAMP)购自BioLog。phospho-ERK1/2抗体(#9101)和总ERK1/2抗体(#9102)购自Cell Signaling。
菌株及培养条件
NTHi 12、2627和9274株临床分离株用于本研究。NTHi是在37°C、5% CO的气氛下在巧克力琼脂板上生长的2过夜后接种于添加3.5 μg/ml NAD和10 μg/ml血红蛋白的脑心灌注(BHI)肉汤中(BD Biosciences)。过夜孵育后,将细菌传代到新鲜BHI和对数相NTHi中,通过测量光密度值进行监测,洗涤并悬浮在磷酸盐缓冲盐水(PBS)中在体外细胞实验在活的有机体内动物实验。
细胞培养
下面描述的所有培养基都添加了10% (vol/vol) FBS (Sigma-Aldrich)。人中耳上皮HMEEC-1细胞在添加了BEGM SingleQuots (Lonza)的DMEM (Cellgro)中维持。人肺上皮细胞A549在F-12K培养基(Gibco)中维持。人宫颈上皮细胞HeLa维持在MEM培养基(Cellgro)中。
实时定量RT-PCR分析
用TRIzol试剂(Life Technologies)按照厂家说明进行总RNA分离。反转录反应使用TaqMan反转录试剂(Life Technologies),如前所述[23,24]。定量RT-PCR分析使用SYBR Green Universal Master Mix (Life Technologies)进行PCR扩增。简而言之,该反应共包含3个重复,包含2× Universal Master Mix, 1 μl模板cDNA, 200 nM引物,最终体积为12.5 μl,并在96孔光学反应板中进行分析(USA Scientific)。使用StepOnePlus Real-Time PCR系统和生产商相应的软件(StepOnePlus软件v2.3;生命技术)。采用比较Ct法测定mrna的相对数量,体外以人亲环素或体内以小鼠甘油醛-3-磷酸脱氢酶(GAPDH)作为内源对照归一化。人GM-CSF和嗜环蛋白的引物已经报道过[25]。小鼠GM-CSF和GAPDH的引物序列如下:小鼠GM-CSF (Forward 5 ' -ATGCCTGTCACGTTGAATGAAG-3 '和Reverse 5 ' - gcgggtctgcacacatgta -3 ')和小鼠GAPDH (Forward 5 ' -ACCCAGAAGACTGTGGATGG-3 '和Reverse 5 ' - ggatgcagggatgttct -3 ')。
质粒,转染
MEK组成活性形式的表达质粒(MEK CA)之前已经描述过[26]。所有瞬态转染均按照制造商说明使用TransIT-2020试剂(Mirus)进行。
酶联免疫吸附试验
用NTHi刺激细胞12小时。收集细胞培养上清,15,000 × g离心10分钟以清除碎片,然后进行分析。用PeproTech人GM-CSF ELISA开发试剂盒(PeproTech)按说明书要求检测人GM-CSF蛋白。
免疫印迹
Western blot采用裂解缓冲液(20 mM Tris-HCl (pH 7.4)、50 mM NaCl、50 mM Na)中的全细胞提取物4P2O7, 30 mM NaF, 5 μM ZnCl2, 2 mM碘乙酸,1% Triton-X,补充1 mM Na3.签证官4和PIC),在10% (wt/vol) SDS-PAGE
凝胶上分离,并转移到聚偏二氟乙烯(PVDF)膜(GE Healthcare Life Sciences)。用含0.1% Tween 20的TBS溶液(TBS- t)中5% (wt/vol)脱脂奶粉堵塞膜。然后在1:10 000稀释的一抗中孵育膜,5% (wt/vol)无脂干牛奶- tbs - t。在TBS-T中洗涤三次后,用1:5 000稀释的相应二抗在5% (wt/vol)的无脂干牛奶中孵育膜。使用Amersham ECL Prime Regent (GE Healthcare Life Sciences)对各自的蛋白质进行可视化。
小鼠和动物实验
C57BL/6J小鼠(10-12周龄)麻醉后经脑室接种1×107NTHi的菌落形成单位(c.f.u),PBS作为对照。接种NTHi 5 h后处死小鼠。对解剖的小鼠中耳进行总RNA提取。所有的动物实验都是按照佐治亚州立大学动物保护和使用委员会(IACUC)的指导方针进行的,并得到了批准。
统计分析
所有实验至少重复三次。数据以平均值±SD表示。统计分析采用非配对双尾学生进行t以及。P < 0.05被认为具有统计学意义。
NTHi诱导人体外上皮细胞和小鼠中耳细胞中GM-CSF的表达
我们最近报道了NTHi,一种主要的OM和COPD加重的人类病原体,诱导GM-CSF在人支气管上皮BEAS-2B细胞中的表达上调[25,27]。然而,NTHi负调控GM-CSF诱导的分子机制尚不清楚。我们首先通过定量PCR (Q-PCR)分析NTHi是否诱导GM-CSF在一些人上皮细胞系中的表达。NTHi诱导人中耳上皮细胞HMEEC-1细胞(图1A)、人肺上皮细胞A549细胞(图1B)和人宫颈上皮细胞HeLa细胞(图1C) mRNA水平的GM-CSF表达。此外,我们确定NTHi以剂量依赖的方式诱导GM-CSF表达(图1d)。为了进一步确定我们的发现的广泛性,我们检测了几种NTHi菌株的GM-CSF mRNA诱导[28]。NTHi菌株2627和9274也在mRNA水平上诱导HMEEC-1细胞中GM-CSF的表达(图1e)。此外,NTHi还能在蛋白水平上诱导HMEEC-1细胞中GM-CSF的表达(图1f)。符合在体外数据显示,NTHi也增强了小鼠中耳GM-CSF mRNA水平的表达(图1G)。总之,这些数据表明,NTHi诱导GM-CSF在人类上皮细胞的mRNA和蛋白水平的表达在体外还有老鼠的中耳在活的有机体内.
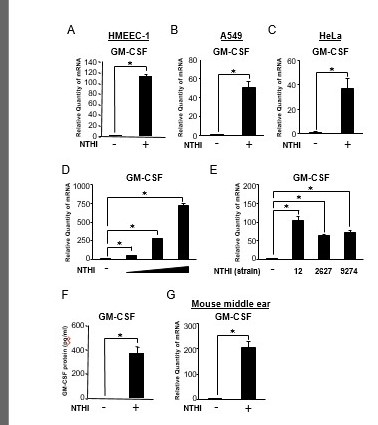
图1所示。
NTHi诱导GM-CSF在人上皮细胞中的表达在体外还有老鼠的中耳在活的有机体内.(A、B、C) HMEEC-1 (A)、A549 (B)、HeLa (C)细胞用NTHi刺激5h, Q-PCR分析GM-CSF mRNA表达。(D)增加NTHi剂量刺激HMEEC-1细胞5h, Q-PCR分析GM-CSF mRNA表达。(E)用不同菌株NTHi(12、2627、9274)刺激HMEEC-1细胞5h, Q-PCR分析GM-CSF mRNA表达。(F)用NTHi刺激HMEEC-1细胞12h,用酶联免疫吸附法分析上清液中GM-CSF的蛋白水平。(G) C57BL/6J小鼠经鼓室接种NTHi (1×107用Q-PCR检测GM-CSF mRNA的表达。数据为均值±SD (n = 3);* P < 0.05。
MEK-ERK信号在nthi诱导的人中耳上皮细胞GM-CSF表达中是必需的
因为我们之前已经证明MAP激酶ERK在调控nthi诱导的炎症反应中至关重要[26,29],我们首先通过Q-PCR分析检测了特异性ERK抑制剂PD98059和U0126对nthi诱导的GM-CSF表达的影响。如图2A和2B所示,ERK抑制剂在mRNA水平上显著抑制nthi诱导的GM-CSF表达增强,且呈剂量依赖性,说明nthi诱导的GM-CSF表达需要ERK的激活。接下来,我们试图确定ERK的激活是否也是充分的GM-CSF诱导,通过表达构成活性形式的MEK (MEK CA),它磷酸化ERK并导致ERK的激活。正如预期的那样,在HMEEC-1细胞中表达MEK CA可显著诱导GM-CSF的表达(图2C)。此外,ERK抑制剂U0126也显著抑制MEK ca诱导的GM-CSF表达(图2D)。综上所述,这些结果表明MEK-ERK信号在nthi诱导的人中耳上皮细胞GM-CSF表达中是必需的。
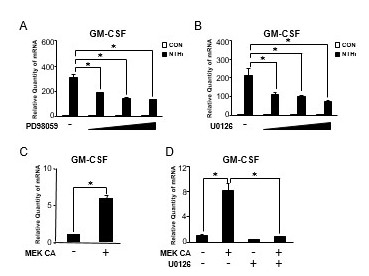
图2。
MEK-ERK信号通路是nthi诱导人中耳上皮细胞GM-CSF表达所必需的。(A)用PD98059(2.5、5和10 μM)预处理HMEEC-1细胞1 h,再用NTHi刺激5 h, Q-PCR分析GM-CSF mRNA表达。(B)用U0126(1、5、10 μM)预处理HMEEC-1细胞1 h,再用NTHi刺激5 h,用Q-PCR分析GM-CSF mRNA表达。(C)用组成型活性的MEK (MEK CA)转染HMEEC-1细胞24 h,并用Q-PCR分析GM-CSF mRNA的表达。(D)转染MEK CA 24 h的HMEEC-1细胞用10 μM U0126处理2 h,用Q-PCR分析GM-CSF mRNA表达。数据为均值±SD (n = 3);* P < 0.05。
cAMP升高通过抑制ERK抑制nthi诱导的人中耳上皮细胞GM-CSF的表达
cAMP是炎症和免疫反应的关键调节因子,长期以来被认为是一种有前景的炎症治疗靶点[22,30]。因此,我们首先试图通过forskolin来确定cAMP在nthi诱导的GM-CSF表达中的作用,forskolin是一种强有力的腺苷酸环化酶激活剂,它导致人中耳上皮细胞[31]中细胞内cAMP的增加。如图3A所示,forskolin在HMEEC-1细胞中以剂量依赖的方式显著抑制nthi诱导的GM-CSF表达。接下来,我们试图通过western blot分析确定forskolin升高cAMP是否调节nthi诱导的ERK磷酸化。在HMEEC-1细胞中,forskolin显著抑制nthi诱导的ERK磷酸化(图3B)。我们进一步证实forskolin是否也能抑制MEK ca诱导的GM-CSF表达和ERK磷酸化。如图3C和3D所示,forskolin显著抑制MEK ca诱导的GM-CSF表达和ERK磷酸化。综上所述,这些数据表明cAMP的升高通过抑制ERK抑制nthi诱导的人中耳上皮细胞GM-CSF的表达。
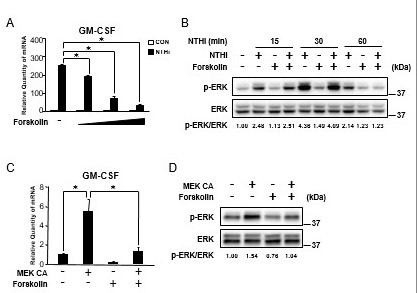
图3。
cAMP升高通过抑制ERK抑制nthi诱导的人中耳上皮细胞GM-CSF的表达。(A)用forskolin(0.1、1、10 μM)预处理HMEEC-1细胞1 h, NTHi刺激5 h, Q-PCR分析GM-CSF mRNA表达。(B) HMEEC-1细胞用forskolin (1 μM)预处理1小时,然后NTHi刺激指定时间,细胞裂解液用所示抗体进行免疫印迹分析。用密度仪定量磷酸化ERK的折射率变化,并归一化至总ERK。(C)转染MEK CA 24 h的HMEEC-1细胞用forskolin (1 μM)处理2 h, Q-PCR分析GM-CSF mRNA表达。(D)转染MEK CA 24 h的HMEEC-1细胞用forskolin (1 μM)处理2 h,细胞裂解液用所示抗体进行免疫印迹分析。用密度仪定量磷酸化ERK的折射率变化,并归一化至总ERK。A和C的数据为均值±SD (n = 3);* P < 0.05。
2021年版权燕麦。所有权利reserv
PKA通过抑制MEK-ERK信号通路负调控nthi诱导的人中耳上皮细胞GM-CSF表达
我们发现cAMP参与了nthi诱导的HMEEC-1细胞中GM-CSF的表达,接下来我们研究了cAMP效应PKA[15]的作用。如图4A所示,选择性PKA激活剂(6-Phe-cAMP)以剂量依赖的方式显著抑制nthi诱导的GM-CSF表达。这一数据表明,camp依赖的PKA激活参与了nthi诱导的GM-CSF表达的负调控。我们进一步评估了PKA参与nthi诱导的HMEEC-1细胞中GM-CSF表达的情况,该细胞经选择性PKA抑制剂(H89)和forskolin处理。如图4B所示,H89可明显逆转forskolin对nthi诱导的GM-CSF表达的抑制作用。接下来,我们确定MEK ca诱导的GM-CSF表达是否受PKA的调控。如图4C所示,PKA激活剂6-Phe-cAMP显著抑制MEK ca诱导的GM-CSF表达。综上所述,PKA通过抑制人中耳上皮细胞MEK-ERK信号通路负调控nthi诱导的GM-CSF表达(图4D)。
综上所述,我们的研究首次证明camp依赖的PKA通路在NTHi诱导MEK/ erk介导的GM-CSF中起负调控作用。这一发现具有特殊的翻译意义,因为MEK-ERK信号通路长期以来被认为是一个有前景的治疗靶点。了解cAMP和ERK激活之间的内在联系为ERK信号被激活的疾病提供了新的治疗潜力。然而,值得注意的是,由于MEK-ERK信号通路在细胞凋亡和细胞生长中发挥的关键作用,延长对该通路的操纵可能会导致不必要的副作用。因此,涉及操纵MEK-ERK信号通路的治疗应限于短期使用。未来的研究可能会对nthi诱导的炎症的细微差别提供独特的理解,并为开发新的治疗策略提供方向。这项研究不仅将为控制对细菌感染的免疫反应提供关键的理解,而且其意义也可应用于其他感染性和炎性疾病。
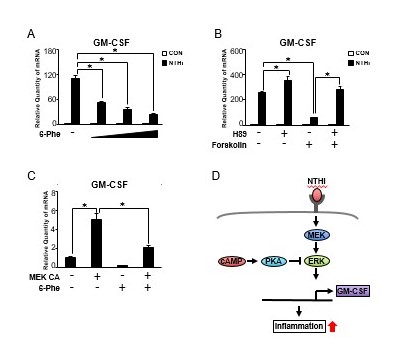
图4。
PKA通过抑制MEK-ERK信号通路负调控nthi诱导的人中耳上皮细胞GM-CSF表达。(A) 6-Phe- camp (6-Phe, 0.1, 0.3, 0.5 mM)预处理HMEEC-1细胞1 h, NTHi刺激5 h, Q-PCR分析GM-CSF mRNA表达。(B) H89 (20 μM)和forskolin (1 μM)预处理HMEEC-1细胞1 h, Q-PCR分析GM-CSF mRNA表达。(C)转染MEK CA 24 h的HMEEC-1细胞用6-Phe-cAMP (0.5 mM)处理2 h, Q-PCR分析GM-CSF mRNA表达。(D) camp依赖的PKA通过抑制MEK-ERK信号通路负调控nthi诱导的GM-CSF表达的示意图。数据为均值±SD (n = 3);* P < 0.05。
本研究得到了国家卫生研究院DC005843、DC004562、DC013833 (j - d - l)和日本促进科学协会(JSPS)促进脑循环战略青年学者海外访问项目(批准号S2510)的资助。j - d.l.是佐治亚研究联盟炎症和免疫领域的杰出学者。
作者声明没有利益冲突。
- Reichman J, Healey WC(1983)涉及中耳炎的学习障碍和传导性听力损失。J学习Disabil16: 272 - 278。(Crossref)
- Bluestone CD, Beery QC, Paradise JL (1973) Paradise,听力测量和鼓室测量与儿童中耳积液的关系。喉镜83: 594 - 604。
- Faden H, Duffy L, Williams A, kristofik DA, Wolf J(1995)出生后2年鼻咽部非分型流感嗜血杆菌定植的流行病学。J感染说172: 132 - 135。(Crossref)
- Arguedas A, Kvaerner K, Liese J, Schilder AG, Pelton SI(2010) 9个国家的中耳炎:疾病负担和管理。小儿耳鼻喉科74:1419-1424。(Crossref)
- Ito M, Hotomi M, Maruyama Y, Hatano M, Sugimoto H, Yoshizaki T, et al,(2010)非可分型流感嗜血杆菌(BLPACR)菌株在日本日托儿童中的克隆传播。儿科耳鼻喉科74: 901 - 906。(Crossref)
- MacArthur CJ, Hausman F, Kempton JB, Choi D, Trune DR(2013)中耳炎影响数百个小鼠中耳和内耳基因。《公共科学图书馆•综合》8: e75213。(Crossref)
- Smirnova MG, Birchall JP, Pearson JP(2004)免疫调节和过敏相关细胞因子在分泌性中耳炎病因学中的作用。介质Inflamm13: 75 - 88。(Crossref)
- Leichtle A, Lai Y, Wollenberg B, Wasserman SI, Ryan AF(2011)先天性中耳炎信号:发病机制和恢复。过敏性哮喘代表11: 78 - 84。(Crossref)
- Medzhitov R(2008)炎症的起源和生理作用。自然454: 428 - 435。(Crossref)
- Hamilton JA(2008)炎症和自身免疫中的集落刺激因子。Nat Immunol牧师8: 533 - 544。(Crossref)
- Basu S, Dunn AR, Marino MW, Savoia H, Hodgson G, Lieschke GJ,等(1997)粒细胞-巨噬细胞集落刺激因子缺陷小鼠对内毒素的耐受性增加。J Immunol 159: 1412-1417。(Crossref)
- Brissette WH, Baker DA, Stam EJ, Umland JP, Griffiths RJ (1995) GM-CSF能快速启动小鼠,增强对LPS和TNF的反应中细胞因子的产生。细胞因子7: 291 - 295。(Crossref)
- Himi T, Suzuki T, Kodama H, Takezawa H, Kataura A(1992)分泌性中耳炎中细胞因子的免疫学特征。安耳鼻喉补品157: 21 - 25日。
- Ollivier V, Parry GC, Cobb RR, de Prost D, Mackman N(1996)在人单核细胞和内皮细胞中,升高的环磷酸腺苷抑制nf - kapab介导的转录。J临床生物化学271: 20828 - 20835。
- 程晓霞,季志华,蔡淑芳(2008)Epac和PKA:两种细胞内cAMP受体的研究进展。生物物理学报(上海)40: 651 - 662。(Crossref)
- Hertz AL, Bender AT, Smith KC, Gilchrist M, Amieux PS, Aderem A, et AL .(2009)升高的环AMP和PDE4抑制诱导人单核细胞来源的巨噬细胞趋化因子表达,美国国家科学院学报106: 21978 - 21983。
- Gerlo S, Kooijman R, Beck IM, Kolmus K, Spooren A, et al.(2011)环AMP: NF-IºB作用的选择性调制器。细胞分子生命科学68: 3823 - 3841。(Crossref)
- Oldenburger A, Roscioni SS, Jansen E, Menzen MH, Halayko AJ, et al. (2012) cAMP效应因子Epac和PKA在慢性阻塞性肺疾病中的抗炎作用。《公共科学图书馆•综合》7: e31574。(Crossref)
- Seldon PM, Barnes PJ, Meja K, Giembycz MA(1995)通过磷酸二酯酶4抑制剂抑制人外周血单核细胞脂多糖诱导的肿瘤坏死因子-产生:与腺苷酸环化酶刺激剂相互作用。摩尔杂志48: 747 - 757。
- Kunkel SL, Spengler M, May MA, Spengler R, Larrick J, Remick D, et al.(1988)前列腺素E2调节巨噬细胞源性肿瘤坏死因子基因表达。J临床生物化学263: 5380 - 5384。
- (2010)环磷酸腺苷类似物对人白细胞中细胞因子产生的调节作用。干扰素细胞因子Res30: 883 - 891。
- Raker VK, Becker C, Steinbrink K (2016) cAMP通路作为自身免疫和炎症性疾病的治疗靶点。前面Immunol7: 123。(Crossref)
- Komatsu K, Lee JY, Miyata M, Hyang Lim J, Jono H,等(2013)PDE4B抑制通过增加去泛素酶CYLD的表达来抑制炎症。Nat Commun4: 1684。(Crossref)
- Miyata M, Lee JY, Susuki-Miyata S, Wang WY, Xu H1, et al.(2015)糖皮质激素通过上调阴性调节因子IRAK-M抑制炎症。Nat Commun6: 6062。(Crossref)
- suuki -Miyata S, Miyata M, Lee BC, Xu H, Kai H, et al. (2015) PKA-Cβ和p65之间的交互作用介导了roflilast和NTHi对PDE4B的协同诱导。美国国立科学院科学研究所112: e1800 - 1809。(Crossref)
- Wang WY, Komatsu K, Huang Y, Wu J, Zhang W, Lee JY, et al. (2014) CYLD通过磷酸酶mmp -1依赖性抑制ERK负调控非分型流感嗜血杆菌诱导的IL-8表达。《公共科学图书馆•综合》9: e112516——e1125169。
- Andrews CS, Matsuyama S, Lee BC, Li JD(2016)白藜芦醇通过上调阴性调节因子MyD88 short抑制nthi诱导的炎症反应。Sci代表6: 34445。(Crossref)
- Gu XX, Tsai CM, Apicella MA, Lim DJ(1995)非分型流感嗜血杆菌释放和细胞结合脂低聚糖的定量和生物学特性。感染Immun63: 4115 - 4120。(Crossref)
- Wang B, Cleary PP, Xu H, Li JD(2003)通过p38和细胞外信号调节激酶途径上调不可分型流感嗜血杆菌的白细胞介素-8。感染Immun71: 5523 - 5530。(Crossref)
- Kaur M, Holden NM, Wilson SM, Sukkar MB, Chung KF, Barnes PF, et al.(2008) 2-肾上腺素受体激动剂和其他camp升高剂对人ASM细胞炎症基因表达的影响:蛋白激酶a的作用。肺细胞与分子生理学295: L505-L514。
- Forskolin:腺苷酸环化酶的特异性刺激因子还是具有多位点作用的二萜?趋势杂志Sci10: 442 - 447。





