摘要
乙醇是一种被滥用的精神活性药物,酗酒被正式认定为一种病理。酒精与几种中枢神经递质系统相互作用,其中包括多巴胺(DA)、血清素(5-HT)和缩胆囊素(CCK)等多肽。
伏安法是一种电化学方法,用于直接在现场和实时测量电子活性化学物质。特别是差分脉冲伏安法(DPV)与微生物传感器相关,如经过特殊处理的碳纤维微电极(mCFE)已被证明能够测量啮齿动物离散脑区的多巴胺(DA)和血清素(5-HT)代谢以及CCK水平。
本研究监测了自发性饮酒大鼠(AD大鼠)额叶皮质(FR1)、尾状壳核、伏隔核和海马(特别是CA3区)中DA和5-羟色胺代谢的dp伏安水平以及与CCK相关的肽能信号的代谢水平,并将其与聚集在水偏好大鼠(WP大鼠)中的大鼠进行了比较。选择这些区域是因为它们与药物依赖现象有关,并且在naïve大鼠中获得了AD大鼠和WP大鼠,这些大鼠在水和酒精之间自由选择。
结果表明,AD大鼠CA3海马区DA和5-HT代谢及肽能(CCK)水平发生选择性改变,提示该区域对酒精特别敏感。
由于这些数据是在成年大鼠中获得的,因此有可能表明,酒精不仅会选择性地改变青少年的海马功能,而且也会改变成人的海马功能。这可能是有用的指示,发展创新的药理学方法,以酒精滥用在青少年和成人成瘾。
关键字
酒精,自由选择,伏安法,大鼠脑,多巴胺,血清素,胆囊收缩素
介绍
酒精是仅次于咖啡因的第二大滥用精神药物。1990年,美国医学协会正式承认酗酒是一种病理。为了开发治疗酒精滥用的新药,最近的研究表明,乙醇与几种中枢神经递质系统相互作用,例如:
-通过增加GABA受体的数量来提高GABA能系统的活性[1,2];
-多巴胺能系统:导致增加[3,4]或减少[5,6];
-血清素能系统似乎在控制乙醇摄入中起作用[5,7];
CCK受体拮抗剂对naïve大鼠的CCK系统产生乙醇偏好[8,9];
-一氧化氮系统:其中乙醇,在药理学显著剂量,强烈抑制纹状体一氧化氮•产生和释放明显通过抑制NMDA受体功能。NMDA受体介导的NO活化的抑制•通路可能是乙醇作用的主要神经生物学机制[10]。
伏安法是一种电化学方法,用于直接在现场和实时测量电子活性化学物质,而无需样品制备或色谱分析。
特别是与微型生物传感器相关的DPV,特别是经过特殊处理的碳纤维微电极(mCFE)直径为7至30微米(图1),是一种电化学方法,可以监测离散脑区细胞外液中的特定化合物[11]。该方法符合检查细胞外液中特定化合物所需的大多数条件[12]。在这里,DPV已经在大鼠的不同脑区进行了实验,这些大鼠被要求在水和酒精之间自由选择(13)。尤其是多巴胺代谢物(DOPAC)、5-HIAA(5-羟色胺代谢物)水平和与CCK相关的肽能信号水平[13-16]在额叶皮质(FR1)、尾状壳核、伏隔核和海马,特别是CA3区域受到监测。选择这些区域是因为它们与药物依赖现象有关[17-22]。
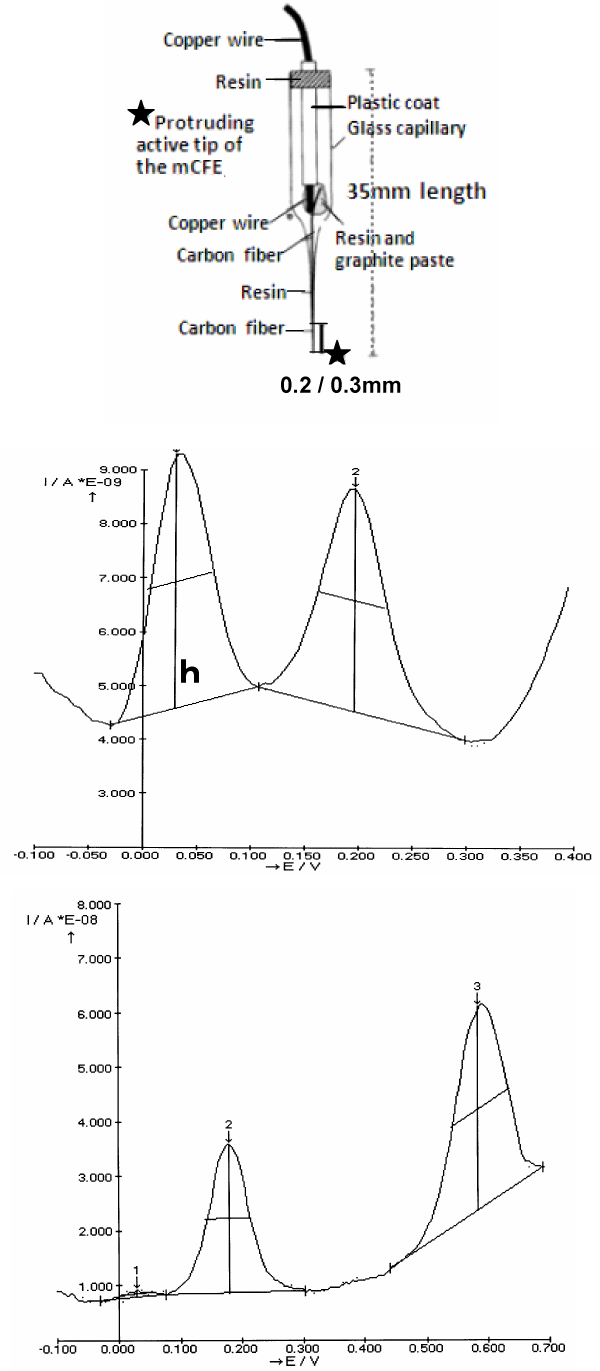
图1所示。上图:这里使用的微生物传感器(mCFE)的示意图。突出的活动尖端(大约200/300 μm长度)先前按照方法中所述进行处理
中间:典型的体外DPV扫描是用mCFE浸泡在pH 7.4的PBS溶液中,其中含有DOPAC, 50 μM和5HIAA, 25 μM的混合物。
它产生两个不同的氧化峰,分别在大约30m伏和200m伏(X轴)。
h:以纳安培为单位测量的峰值大小(Y轴)
底:典型的体外DPV扫描是将mCFE浸入pH 7.4的PBS溶液中,其中含有5-HIAA, 25 μM和CCK 50 μM的混合物。结果是两个不同的
氧化峰分别在约200m伏和600m伏处
氧化电位(X轴)和氧化电流(Y轴)的测量由Autolab极谱仪(荷兰Ecochemie公司的恒电位仪/恒流仪)自动完成。
连接到一台装有通用电化学系统软件(GPES)包的IBM个人电脑上
所收集的dp伏安数据表明,海马CA3区儿茶酚胺能和血清素能代谢水平以及肽能信号水平发生了选择性的显著变化,而在所分析的其他脑区中未发现上述伏安信号的显著变化。
方法
如前所述,dp伏安法通过三电极恒电位器系统进行应用[11,12,14]。采用直径为12µm的碳纤维(Carbone Lorraine, Lyon, France),电活性针尖长度为0.2 / 0.3mm,先用0 ~ 3伏,70 Hz, 10 s的电压处理,然后用连续电位(+1.5伏,5 s和- 0.9伏,5 s)处理mCFE,并在体外连续标定mCFE。工作电极浸泡在pH 7.4的0.1 M磷酸盐缓冲盐水(PBS)中[14-16]。电化学处理可以检测三个独立的峰在体外5mM抗坏血酸溶液;DOPAC 50μM;和5-HIAA, 25μM,如已证明[11,14]。此外,它还允许在体外在添加氨基酸或多肽的相同溶液中进行DPV记录[15,16],DPV扫描速率为10mV/s,从-250 mv到+950mV,步长为50mV(图1)。
氧化电位和氧化电流的DPV测量由Autolab极谱仪(荷兰Ecochemie公司的恒电位仪/恒流仪)自动完成,该极谱仪连接到一台装有通用电化学系统软件(GPES)包的IBM pc电脑。
动物
选用意大利Charles-River公司提供的成年雄性大鼠20只(Wistars, 220-250 g),饲养在温湿控制室(22○C, 50%)。所有动物手术均按照意大利法律进行(立法法令no. 11)。116, 1992),承认欧洲指令86/609/EEC,并完全符合葛兰素史克公司关于实验动物的护理和使用政策和操作规范。此外,所有的努力都是为了尽量减少动物的数量和它们的痛苦。
行为
在适应酒精的第一周,动物接受2%乙醇(v/v)的溶液,这种溶液已知不具有选择性[23,24]。随后,动物们被要求在一瓶淡水和一瓶浓度为10% V/V的乙醇溶液之间自由选择,这已经证明可以在嗜酒大鼠(AD大鼠)和嗜水大鼠(WP大鼠)之间进行选择[13,23,24]。关于这里使用的饮酒自由选择程序的详细信息,请参见参考文献13。
离体DPV
在饮酒行为结束时,将大鼠处死,迅速切除大脑,制备脑切片,然后按照前面的描述进行DPV测量[13,25]。
统计分析
行数据进行方差分析,使用Bonferroni (Dunn’s)检验比较WP大鼠和AD大鼠的值。然后用对照值的%表示结果,mean±s.e.m., *p < 0.05。
结果
饮酒行为
在适应周内,所有动物的2%乙醇摄入量(v/v)相似。随后,在水和10% v/v乙醇溶液之间进行自由选择,可以获得大量消耗10% v/v乙醇的大鼠。这些被称为饮酒(AD)大鼠,约占受测动物总数的40%。这发生在4周内,当AD大鼠达到每天15.2±3.4 ml乙醇10% v/v的正常消耗量时(的意思是±s.e.m)。其余的大鼠,所谓的水偏好(WP)不喜欢饮酒,因为它们每天只摄入大约3.2±1.1 ml的水(平均)±s.e.m)(图2)。
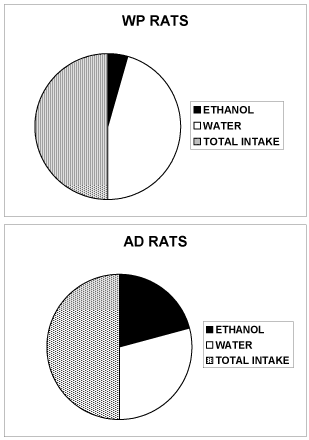
图2。当大鼠(WP或AD)在1瓶水和1瓶10% v/v乙醇之间自由选择时,每天消耗的水和10% v/v乙醇总量(ml)。([13]有关行为酒精和水自由选择程序的详细信息)
WP大鼠:乙醇3±1ml, 10% v/v,水31±4ml。
AD大鼠:乙醇15±3ml, 10% v/v,水21±5ml。
数据以液体消耗量表示,为了清晰起见,省略了扫描电镜
DPVoltammetry
图3为AC3海马切片制备中获得的典型dpv图。使用自动测量每个峰大小的Autolab设备(荷兰Ecochemie)获得四个主要氧化信号(峰)。尺寸(h:以纳安培为单位测量)给出了每个电流信号的直接测量,而横坐标表示特定的氧化电位。
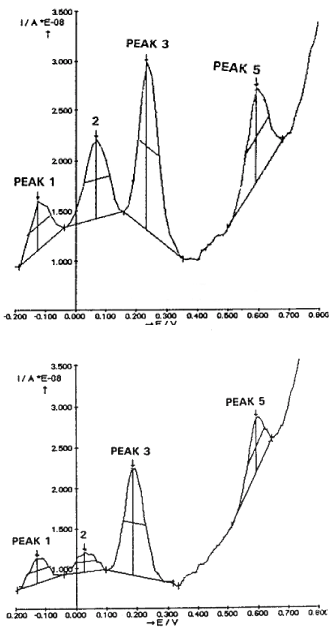
图3。获得了典型的离体dpv图,即在CA3海马与mCFE: 1只WP大鼠为TOP, 1只AD大鼠为BOTTOM
注意Autolab - GPES包自动检测到四个峰,分别对应抗坏血酸(峰1)、DOPAC(峰2)、5- hiaa(峰3)和CCK相关信号(峰5)[11,16]。在大约400mv时,电流基线有一个不显著的变化,可能对应于纹状体中记录的所谓峰4,对应于3-甲氧基酪胺的氧化[29,30]。
图中,最上面的伏安图为WP大鼠CA3切片,最下面的伏安图为AD大鼠CA3切片。在其他WP或AD大鼠中也获得了类似的数据(图4)。注意,在后者中,分别对应DOPAC和5- hiaa氧化的峰2和峰3以及对应CCK氧化的峰5电流大小减小[11,13]。
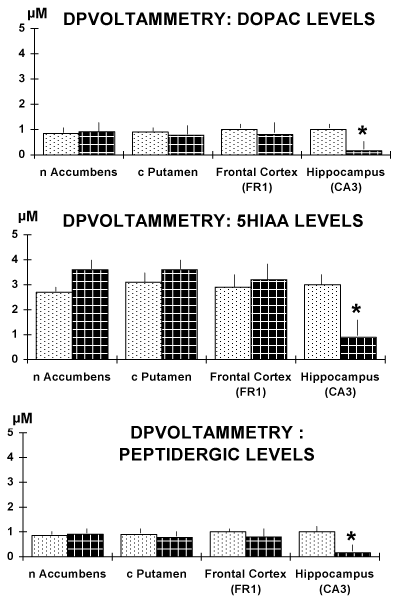
图4。所选四个区域的脑切片结果。值得注意的是,DOPAC和5-HIAA氧化对应的dp伏安信号以及肽能cck样DPV峰氧化对应的dp伏安信号电流大小显著减小[11,13]。
数据以µM级表示,平均值±sem。* p < 0.05。
讨论
人们已经广泛观察到,酒精会影响大脑功能和行为,青少年似乎比成年人更容易在反复饮酒后受到损害[26]。研究表明,酒精通过持续损伤海马,特别是海马CA3子区来改变学习和记忆[17]。同样,评估急性和慢性乙醇暴露影响的行为以及细胞外和全细胞电生理研究清楚地表明,海马功能在发育过程中对乙醇有特异性反应[18]。然而,酒精的作用机制尚不清楚[17]。
对啮齿类动物和人类的研究表明,酒精刺激多巴胺的释放主要在纹状体和伏隔核,这与滥用药物的强化作用有关[19,20]。
额叶皮层也与药物(酒精)成瘾有关,特别是它通过调节腹侧纹状体多巴胺的增加来调节奖励的价值[21]。
此外,通过微透析实验监测了选择性高饮酒量(HAD)和低饮酒量(LAD)小鼠伏隔核中多巴胺、血清素及其主要代谢物DOPAC和5-HIAA的细胞外浓度,结果表明,在HAD组和LAD组中,腹膜内注射1.0和2.0 g乙醇/kg体重组细胞外DA水平升高,而只有2.0 g/kg剂量组细胞外5-HT浓度升高。似乎没有任何乙醇剂量改变其主要代谢物DOPAC和5-HIAA的细胞外水平[22]。
额叶皮层也与药物(酒精)成瘾有关,特别是它通过调节腹侧纹状体多巴胺的增加来调节奖励的价值[21]。
因此,在本研究中,在饮酒(AD)大鼠的大脑区域,即额叶皮质、伏隔核(nAccumbens)和纹状体(c.putamen)收集的dp伏安数据显示,DA和5-HT代谢物DOPAC和5-HIAA的水平没有显著变化。
相比之下,AD大鼠CA3海马区DOPAC和5-HIAA水平明显低于WP大鼠,因此支持了酒精对该脑区选择性影响的假说[18]。
研究表明,CCK除了广泛分布于大脑皮层外,还大量存在于下丘脑和边缘系统的许多区域,特别是海马的CA3区域[27,28]。
利用dp伏安法在体外和体内监测神经肽的可行性已经有报道(11,15,16),并且已经证明,在大约+600mV的氧化电位下发生的肽能信号对应于CCK的氧化[8,13]。
再次,本研究表明,AD大鼠的CA3海马中这种肽能信号与WP大鼠相比显著特异性降低。
这可能与先前报道的证据一致,即肽比生物胺更多地参与药物摄入的自由选择,这表明这些化合物对涉及滥用药物偏好的表型的推测影响。这可能是一个重要的观察,在竞争开发一种新的药理学方法来干扰这种表型,试图减少消费药物的意愿。
此外,由于本实验中涉及的动物是成年大鼠,因此有可能表明,酒精不仅会选择性地改变青少年的海马下部功能[17,18],也会选择性地改变成人的海马下部功能。再一次,这一观察结果可能有助于设计创新的药理学方法来治疗青少年和成人成瘾的酒精滥用。
参考文献
- Ticku MK, Lowrimore P, Lehoullier P(1986)乙醇增强GABA诱导的原代脊髓神经元36cl内流。大脑研究公报17: 123 - 126。
- Roberto M, Madamba SG, Moore SD(2003)乙醇增加大鼠中央杏仁核神经元突触前和突触后的gaba能传递。PNAS100: 2053 - 2058。
- Di Chiara G, Imperato A(1986)酒精和巴比妥类药物优先刺激自由运动大鼠伏隔核释放多巴胺。神经科学研讨会。Fidia研究系列3: 89 - 96。
- Di Chiara G, Bassareo V, Fenu S, De Luca MA(2004)多巴胺与药物成瘾:伏隔核壳连接。Neuropharmacol4: 227 - 24。
- 葛丽娟,陈晓明,陈晓明(1990)[酒精中毒的实验模型]。最近的节目医学81: 162 - 165。(Crossref)
- 马宏,朱刚(2014)多巴胺系统与酒精依赖。上海Arch精神科26日:61 - 68。(Crossref)
- Johnson BA(2004) 5 -羟色胺能系统在酒精中毒的神经生物学中的作用:对治疗的影响。中枢神经系统药物18: 1105 - 1118。(Crossref)
- Crespi F(1998)胆囊收缩素(CCK)、CCK- a或CCK- b受体拮抗剂在幼稚大鼠对滥用药物(酒精或可卡因)的自发偏好中的作用。方法:寻找Exp临床药物20: 679 - 697。(Crossref)
- Crespi F, Corsi M, England T, Ratti E, Trist DG等。(1997)幼年大鼠对乙醇的自发偏好受胆囊收缩素A受体拮抗剂的影响。酒精14: 327 - 332。(Crossref)
- 罗塞蒂,陈志强,陈志强(2004)乙醇酒精对体内一氧化氮释放的抑制作用:临床和实验研究28:1-6。
- Crespi F(1990)用微生物传感器的体内伏安法分析神经递质释放和代谢。J神经科学方法34: 53 - 65。(Crossref)
- 5 -羟色胺,如何找到它。[J]中国科学院学报14-22页。
- Crespi F(1998)胆囊收缩素(CCK)、CCK- a或CCK- b受体拮抗剂在幼稚大鼠对滥用药物(酒精或可卡因)的自发偏好中的作用。方法:寻找Exp临床药物20: 679 - 697。
- Crespi F(1991)用微碳纤维生物传感器在体内伏安法检测神经肽:可能选择性检测生长抑素。学生物化学肛门194: 69 - 76。(Crossref)
- 微传感器和伏安法选择性监测大鼠生长抑素(SRIF):生长因子(GH, EGF)的影响。生物传感器7: 53 - 63。
- Crespi F, Sharp T, maindat N, Marsden CA(1984)差分脉冲伏安法:用单碳纤维电极同时测量大鼠纹状体中抗坏血酸、儿茶酚和5-羟基吲哚。大脑研究322: 135 - 138。
- Zucca S, Valenzuela CF(2010)低浓度酒精通过l型Ca2+通道抑制CA3海马锥体神经元发育中bdnf依赖性gaba能的可塑性神经科学杂志30: 6776 - 6781。
- 白AM, Swartzwelder HS(2206)海马功能在青春期:乙醇效应的独特目标。Ann N Y学术科学1021: 206 - 220。
- Boileau I, Assaad JM, Pihl RO(2003)酒精促进人类伏隔核多巴胺释放。Sinapse49: 226 - 231。
- 杨建军,张建军,张建军,等(2007)酒精对大鼠纹状体多巴胺释放的影响。酒精临床试验中心31日:965 - 973。
- 王广军,王晓东,王晓峰(2007)脑卒中后脑卒中患者脑纹状体多巴胺释放的研究进展。J >27日:12700 - 12706。
- 李国明,李国明,李国明(1992)乙醇对脑卒中大鼠伏隔核多巴胺和血清素释放的影响。酒精临床试验中心16: 781 - 785。
- Richter CP, Campbell KH(1940)大鼠酒精味觉阈值和偏好溶液浓度。科学91: 507 - 508。(Crossref)
- Shoaib M, Almeida O(1996)口服乙醇自我给药后对乙醇负刺激特性的耐受性缺失。酒精:175-180。
- Bull D, Palij M, Millar J(1990)快速循环伏安法在体外脑片电诱发多巴胺溢出测量中的应用。J神经科学方法32: 37-44。
- (2005)酒精对青少年和成人记忆和记忆相关脑功能的影响。在:Galanter M, Lowman C, Boyd GM, Faden VB, Witt E,等。(编辑)酒精中毒的最新进展。酒精中毒的最新进展(青少年和青年的酒精问题),第17卷。斯普林格,波士顿,马萨诸塞州。
- Beinfeld MC, Palkovits M(1981)大鼠下丘脑和边缘系统胆囊收缩素(CCK)的分布。神经肽2:123-129。
- Palkovits M(2013)化学识别地形图?中枢神经系统中的Ed神经元。神经内分泌角度3: 1 - 398。
- Crespi F, Martin KF, Heal DJ, Marsden CA, Buckett WR等。(1989)体内伏安法测定3-甲氧基酪胺:BALB/c和CBA小鼠中枢多巴胺功能差异的证据。大脑Res500: 241 - 246。(Crossref)
- (1990)近交系小鼠纹状体多巴胺水平差异的生物化学和体内伏安证据。神经科学39: 649 - 656。





