自适应设计在肿瘤药物研究中,特别是在抗癌药物的临床试验中,以其高效、经济的优势越来越受到人们的青睐。然而,适应性试验的潜在成功依赖于对适应性设计的彻底理解、详尽的协议前备份、熟练的统计技能和当地监管机构的支持。本文回顾了以往文献对适应性设计试验(ADT)的定义,列举了不同ADT方法与传统随机对照试验相比的优缺点。接下来,我们收集了所有适应性设计的临床试验,展示了每年注册adt的概况,以及旨在加快全球药物批准和商业化的政策/指示。重点介绍了主协议设计在实体肿瘤领域的应用,并分析了国内外多个关键ADT研究的优缺点。最后,基于上面列出的所有元素,我们提出了一个具有自适应主协议设计的最优平台研究协议,并总结了自适应试验设计的重要性和未来潜在的应用前景。
适应性设计试验,实体肿瘤,平台
随机临床试验(rct)是公认的为临床实践提供高质量证据的标准解决方案。传统的试验设计的特点是在特定疾病背景下,按照预先定义的方案比较两种药物[1,2]。随着对可行性、效率和灵活性的需求日益增长,“适应性试验设计”的概念被提出,它强调根据中期数据反馈和预期决策规则自适应地修改临床试验设计。适应性试验设计的灵活性来自于详细审查计划和非计划临床细节的特定原则,这将其与有效性不确定和任意性不充分的准备试验区分开来。自适应试验设计允许研究人员根据累积反馈和持续评估[3],修改治疗的毒性/疗效剂量,从协变量和应答率改进随机化算法,重新定义参与者数量和登记标准,促进试验过渡,同时减少阶段之间的停机时间。适应性试验设计具有成本低、处理速度快、治疗效果可能性大等优点,在效率、灵活性和完整性方面均有突出表现。然而,该试验的有效性仍然需要方案管理、统计验证和伦理关注。
考虑到不同的目的和采用的适应方法,适应试验可进一步分为多种类型。常用的有:a)自适应组序贯设计[5];B)样本量重估计[6];c) I/II期或II/III期两阶段无缝设计[7];D)自适应富集[8];E)自适应设计的主协议[9];F)多重自适应设计[10];G)自适应剂量递增[11];h) Drop-the-loser设计[12];我)自适应treatment-switching [13]; j) Adaptive-hypothesis design(Chow, 2014); k)Biomarker-adaptive design{Chen, 2014) ; l) Multi-arm multi-stage(MAMS) [10,14]; It’s worth mentioning that different types of adaptive design could be utilized in one trial. Besides, designs like adaptive dose-finding or drop the losers, could be applied in trials independently, or manifested as part of these frequently used adaptive trial designs (Figure 1).
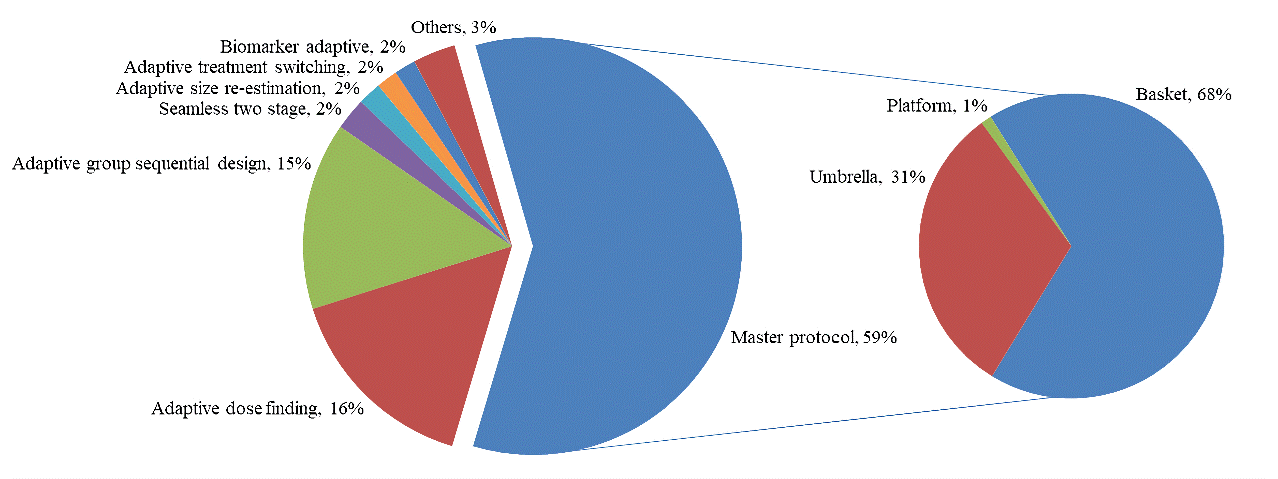
图1所示。全球适应性设计的类型(1998-2020年)。(左)各类别试验次数及其在总试验中的百分比;(右)每一类试验的数量及其在主方案设计试验中的百分比
由于适应性试验与传统试验的显著差异,越来越多的适应性临床设计带来了对指导、共识和法规的迫切需求。欧洲(药品管理局,2007)和美国(食品药品管理局,2010)等国家或地区相继发布了指南和经验。2020年5月,中国药物评价中心(CDE)启动了《临床试验适应性设计指南》,认可了适应性试验的有效性,为复杂的设计提供了参考。
本文总结了1998年1月1日至2020年12月31日期间在中国、美国和世界范围内注册的INFORMA数据库中正在进行和已结束的肿瘤领域适应性药物临床研究。自适应设计植入从1998年的几个案例到近年来的几十个案例,在全球和美国都有不断增长的趋势。与美国相比,中国的自适应试验数刚刚开始积累,潜力仍然很大(图2和表1)[15]。
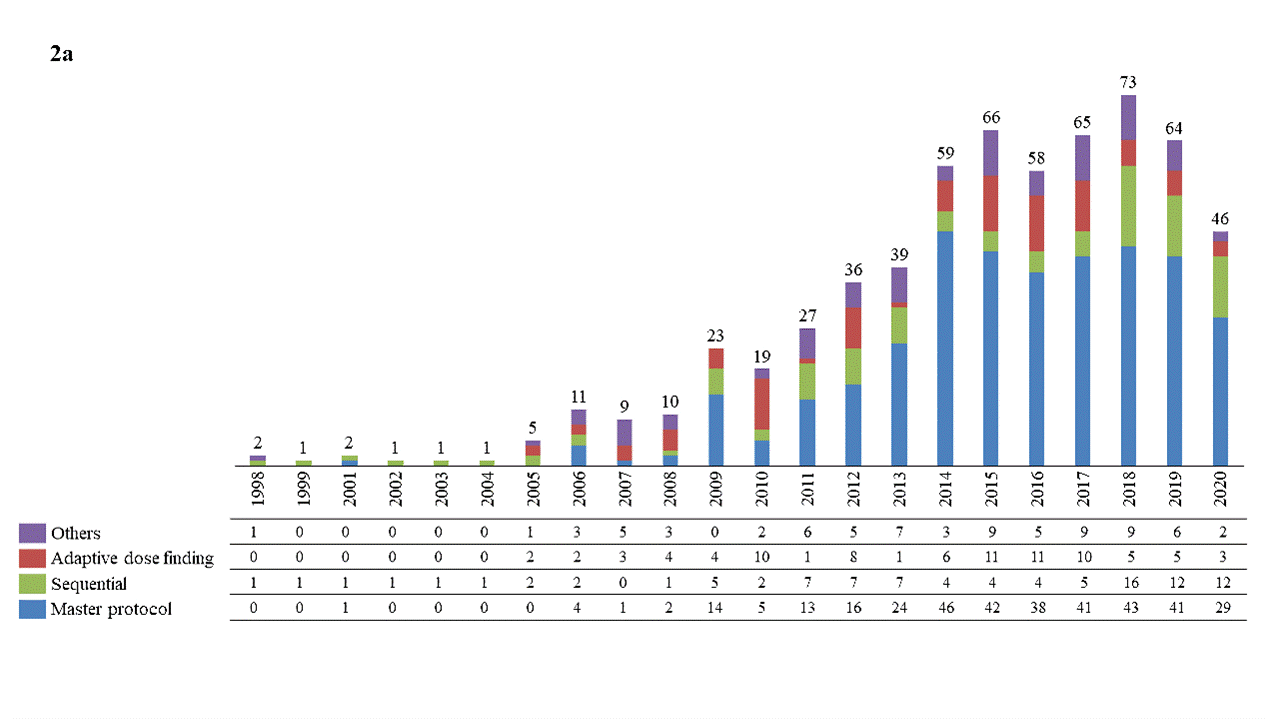
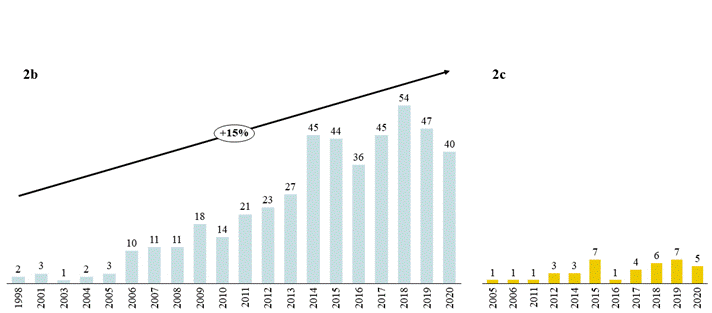
图2。地区每年注册的适应性试验主要类别。自适应试验设计分为主协议设计,自适应组顺序设计,适应性剂量查找和各种国家(全球:2A,美国:2B和中国:2C)
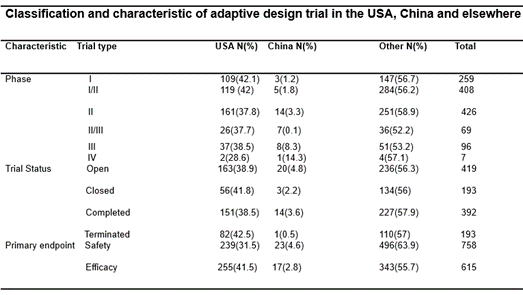
表格1。美国、中国和世界其他国家/地区适应性临床试验数量和特点的比较
全球共搜索了615个具有适应性设计的药物试验。在收集的617个适应性试验中,设计的类别也各不相同,大多数试验使用主协议(59%),适应性组顺序设计(15%)和适应性剂量发现(15%)。在少数试验中,采用了两阶段无缝设计、自适应样本重估和失败者组等方法(图2)。非小细胞肺癌(NSCLC)和检查点抑制剂(主要是PD-1/L1)治疗仍是溶瘤试验研究的重点领域。适应性设计试验也不例外(图3和图4)。此外,我们调查了美国、中国和世界其他地区适应性试验的阶段、状态和主要终点的细节,适应性试验的细节将帮助我们更好地克服障碍,促进肿瘤试验领域应用的增长(表1)。目前这些试验的进展差异很大,从I期到IV期。此外,适应性设计的正在进行的临床试验在不同地区之间分布不均匀。其中,美国ⅰ期临床试验109项(42.1%),中国ⅰ期临床试验3项(1.2%),其他地区ⅰ期临床试验147项(56.7%)。在美国、中国和其他地区,II期临床试验分别有161例(37.8%)、14例(3.3%)和251例(58.9%)。II/III期临床试验分别为26例(37.7%)、7例(0.1%)和36例(52.2%),III期临床试验分别为37例(38.5%)、8例(8.3%)和51例(53.2%)。然而,IV期临床试验在不同地区的分布比较均匀,美国2个(28.6%),中国1个(14.3%),其他地区4个(57.1%)。在这些试验中,在美国、中国和其他地方仍有163项(38.9%)、20项(4.8%)和236项(56.3%)研究开放。 56 (41.8%) and 82 (42.5%) studies were closed or terminated in the US, while 3 (2.2%), 1 (0.5%) and 134 (56.0%), 110 (57.0%) trials were closed and terminated in China and other regions. 151 (38.5%), 14 (3.6%) and 227 (57.9%) studies were completed in the US, China, and other regions respectively. In result, 239 (31.5%) and 255 (41.5%) trials in US have assessed the safety and efficacy of investigated drugs, while the amount of trials assessing safety and efficacy in China and other regions are 23 (4.6%), 17 (2.8%) and 496 (63.9%), 343 (55.7%) accordingly. To summarize, large regional disparity was observed in the amount of clinical trials with adaptive design, with the numbers of studies in US and other regions are significantly higher than in China, indicating adaptive design trial is a relatively novel drug development strategy in China with great potential to facilitate local drug discovery.
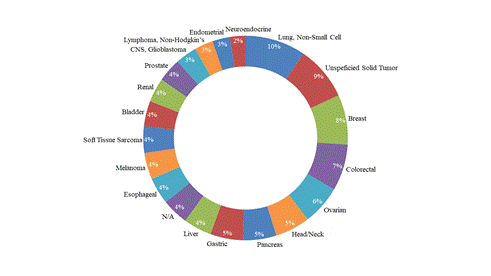
图3。不同肿瘤类型的适应性设计试验分析。非小细胞肺癌是适应性试验设计中大多数临床试验的主要肿瘤类型。术语“未指明的实体瘤”通常见于I期试验或具有广泛治疗适应症的药物
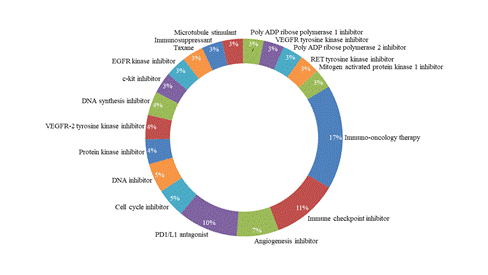
图4。不同靶向机制的适应性设计试验分析。包括PD-1/L1在内的检查点抑制剂仍然是适应性试验设计探索的主要治疗方法
详细讨论了具有自适应试验设计的六项关键研究(表2),即NCT00409968(战斗研究)、NCT01248247(战斗-2)、NCT01771458 (SHIVA)、NCT02154490 (Lung-Map-S1400)、NCT01042379 (I-SPY 2)和NCT02693535 (TAPUR)。所有研究均纳入II/III期癌症患者,适应性设计包括伞和篮子设计。这些试验的主要目的是治疗调查和概念证明,除NCT02693535 (TAPUR)外,其余均为随机试验。
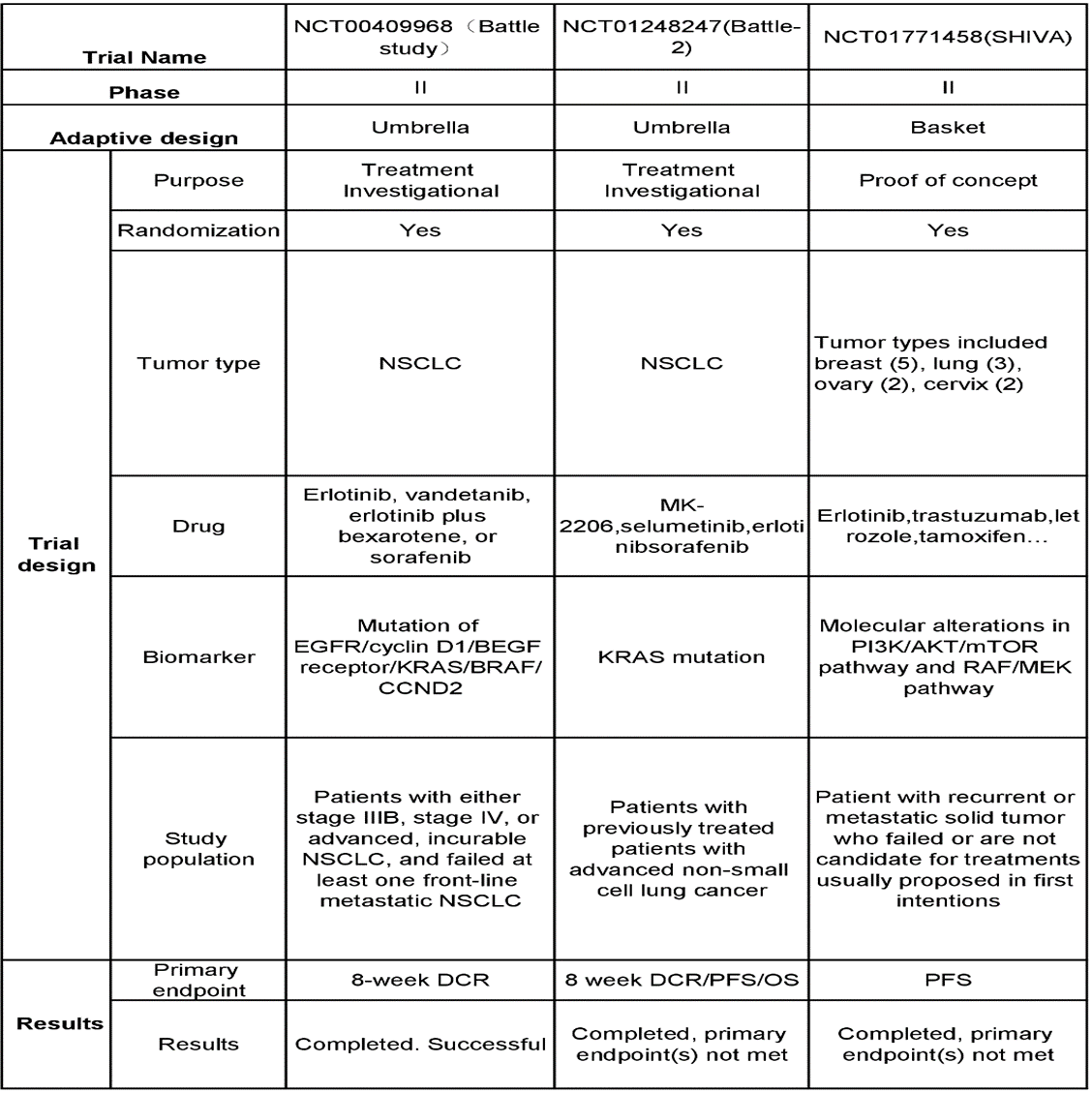
表2。ADTs:适应性设计试验(DCR=疾病控制率,PFS=无进展生存期,OS=总生存期,ORR=客观缓解率,PR=部分缓解,QOL=生活质量,PD-L1=程序性死亡配体1,NSCLC=非小细胞肺癌)。
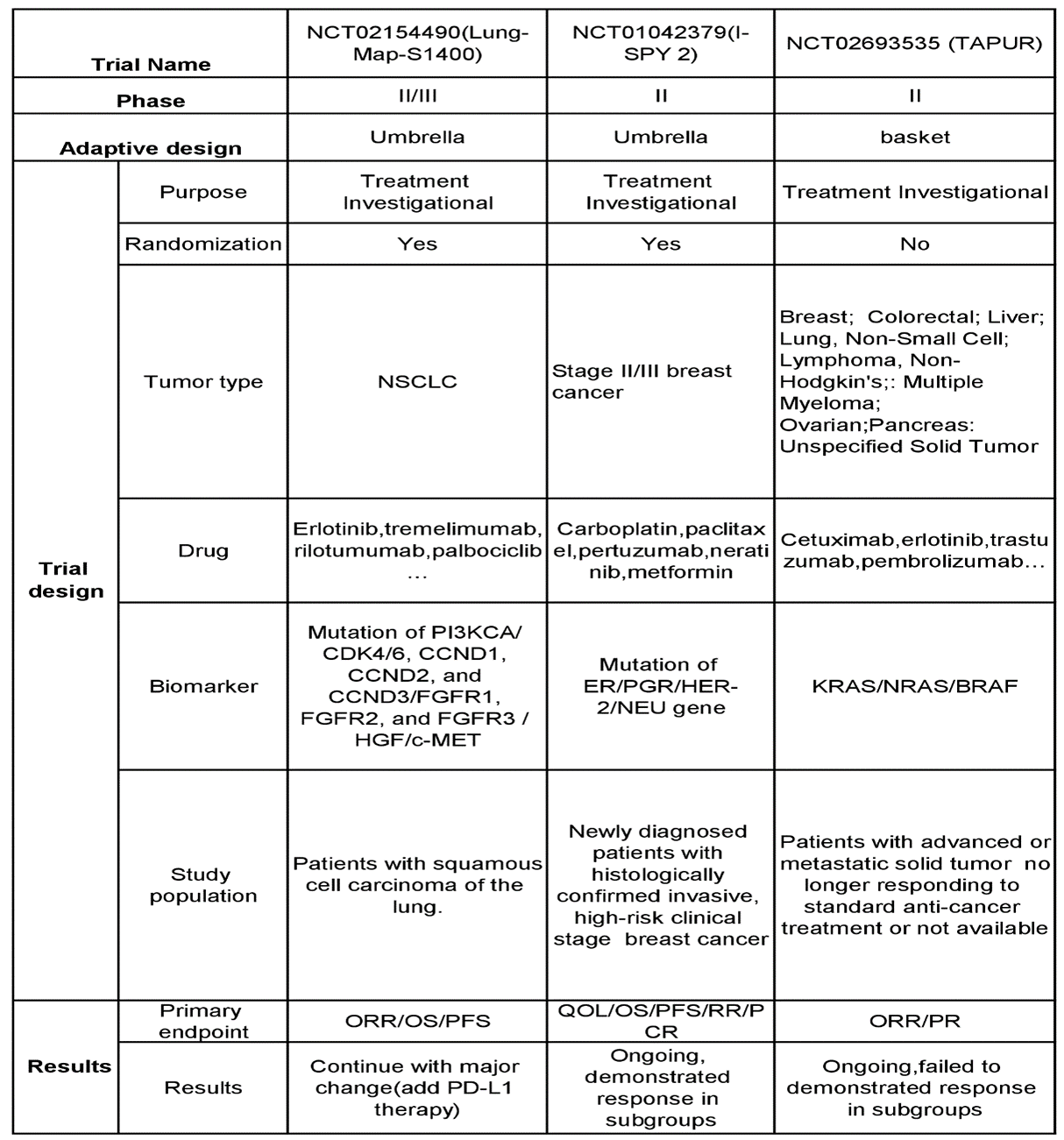
表2。实体肿瘤中主协议设计的关键ADTs的总结:优点和缺点。ADTs:适应性设计试验
在NCT00409968 (Battle study)试验中,研究的肿瘤类型为NSCLC。试验药物包括厄洛替尼、万德替尼、厄洛替尼加贝沙罗替尼和索拉非尼。使用的生物标记物是表皮生长因子受体,BEGF受体,克拉斯,BRAF,CCND2和cyclin D1突变。研究人群是一组诊断为IIIB期、IV期或晚期不可治愈NSCLC,且至少一次一线转移性NSCLC化疗失败的患者。主要终点为8周疾病控制率(DCR),试验成功完成[16]。回顾这项试验,它是第一个完成的对重度预处理NSCLC患者的前瞻性研究,要求使用核心针活检进行肿瘤分析,为开发基于预测性生物标志物的特定方法和后续明确临床试验的相关治疗提供了证据。然而,预先定义的生物标志物组比独特的生物标志物具有稀释的预测价值表皮生长因子受体突变[17]。
NCT01248247(Battle-2)主要纳入既往治疗过的晚期非小细胞肺癌患者。利用的生物标志物有克拉斯评估的突变和药物包括MK-2206,Selumetinib和Erlotinibsorafenib。主要端点是8周DCR / PFS / OS。审判目前已完成,但不符合主要终点[18]。本研究的一个亮点是进一步证实了预处理先进的NSCLC患者的实时活组织检查测序,基于生物标志性,基于生物标志性的基于生物标志性的基于生物标记,适应性的平台试验设计的可行性。尽管如此,它未能在临床药物决策或肿瘤反应和有限的生物标志物之间显示明确的关联(克拉斯突变。需要进一步探索基于生物标志物的免疫治疗。
NCT01771458(Shiva)的试验是唯一一个唯一一个概念概念证明,专注于肿瘤类型,包括乳腺癌(5),肺癌(3),卵巢癌(2)和子宫颈癌(2)。复发或转移性固体肿瘤的患者失败或未在首次意图中提出的治疗候选者。生物标志物包括分子改变PI3K/一种蛋白激酶/MTOR.途径和raf./梅克途径,测试药物包括厄洛替尼、曲妥珠单抗、来曲唑、他莫昔芬等.试验结果的主要终点是无进展生存期。同样,试验已经完成,未达到主要终点[19]。该试验强调了生物标志物在治疗选择和反应预测中的重要性,并敦促在肿瘤免疫领域探索更多的生物标志物,证明了分子靶向药物在适应症之外的应用需要进一步探索。然而,在严重预处理的患者中,它未能显示医生推荐的治疗和分子靶向治疗之间的治疗差异(PFS)。
在NCT02154490 (lung - map - s1400)试验中,研究人群为肺鳞状细胞癌患者,使用包含突变的生物标志物PI3KCA/到/6,CCND1,CCND2,CCND3/FGFR1,FGFR2,FGFR3/HGF/c-MET.评价药物包括厄洛替尼、曲美单抗、利洛单抗、帕波昔布等。试验结果的主要终点为ORR/OS/PFS。试验最终继续进行,并有重大改变(增加PD-L1治疗)[20]。在本研究中,利用适应性设计将生物标志物驱动的靶向药物研究在单一试验下进行分组,降低了筛选失败率,使筛选更有效,成本更低。然而,在试验设计[21]中可以看到,明确的预先定义方案的重要性,并考虑到新药物适应症和生物标志物的一致更新。
NCT01042379 (I-SPY 2),专注于新诊断的II/III期乳腺癌患者,组织学上证实为浸润性、高危临床期乳腺癌。生物标记包括突变呃/PGR/her - 2/NEU基因和评估药物主要包括Carboplatin,紫杉醇,Pertuzumab,书呆子和二甲双胍。主要终点是QoL / OS / PFS / RR / PCR。迄今为止,正在进行研究,证明亚组中的反应[22]。它证明了在早期,高风险的女性中靶向靶向抑制的优势,erbb2.消极的乳腺癌。然而,pCR是否是一种有效的预测长期结果的替代品仍有争议。
同时在NCT02693535(Tapur)试验中同时研究多种肿瘤类型,即乳腺癌,结直肠癌,肝癌,肺癌,非小细胞癌,淋巴瘤,非霍奇金淋巴瘤,多发性骨髓瘤,卵巢癌,胰腺癌,和未指明的实体肿瘤。它注册了患有先进或转移性实体肿瘤的患者,该肿瘤不再响应或无法用于标准抗癌治疗。利用生物标志物包括在内克拉斯/国家管制当局方面/BRAF突变,测试的药物包括西妥昔单抗,厄洛替尼,曲妥珠单抗,派姆单抗,等.试验结果的主要终点为ORR/PR。目前该试验仍在进行中,但在亚组中没有显示出反应。证明西妥昔单抗在晚期BC、NSCLC和OC无临床活性克拉斯,国家管制当局方面,或BRAF突变。然而,它未能显示潜在的基因组生物标志物的作用喀斯特/国家管制当局方面/ BRAF预测西妥昔单抗治疗活性和应答[24]。
实体肿瘤的结构紊乱阻碍了抗癌试剂的传递,给基于分子谱的治疗方法的选择带来了独特的挑战。主方案设计可以进一步分为篮子(探讨多种疾病或亚型中某些治疗的适应症),Umbrella(在同一疾病类别中对已定义的亚型使用不同的治疗方法)和平台(研究和比较特定疾病背景下的各种治疗方法,而预先定义的原则允许以永久的方式获得最佳结果),这对实体肿瘤领域的药物发现和疗效比较有很大的帮助。在这里,我们回顾了主方案设计的这一领域的试验(表2)。在实体肿瘤领域,有18个主方案设计的探索溶瘤治疗的临床试验,有可用的进展记录(12个有中期分析反馈,6个有完成结果)。主方案设计的类别为篮(9)、伞(8)和平台(1,聚焦放疗)。6个完成的试验中,有2个试验未能达到主要终点,成功率为66.7%。这些试验的主要焦点是标准一线治疗失败的III/IV期患者,或患有难治性/转移性实体肿瘤的患者,利用包括生物标志物在内的分子信息来指导治疗组的选择。唯一注册的平台试验集中在放疗上
基于适应性设计的发展和实体肿瘤领域平台试验的独特存在,我们提出了一项针对中国人群中罕见肿瘤的PLATFROM研究。在我们之前的研究中,我们在中国罕见的肿瘤分类分为三个主要类型:实体与罕见histo-molecular表型一年一度的“2.5/100000”的发生率由突变的罕见的细胞类型,与罕见的组织学实体,但一个共同的起源细胞,与常见的组织学和实体,但罕见的分子改变[25]。我们在罕见肿瘤患者中应用了下一代测序,然后根据基因检测结果将他们分为两个治疗亚组,在本研究中两组患者将使用不同的两种治疗方法。基因检测未达标治疗的晚期罕见肿瘤患者,携带可操作的改变(EGFR突变(19外显子缺失突变、L858R置换突变或T790M突变)、ALK基因融合、Ros-1基因融合、MET基因扩增或突变、BRAF突变(V600)、BRCA1/2突变、HER-2阳性(突变或过表达或扩增)、c-kit突变和CDK4扩增或CDKN2A突变将被分为13个研究组,其中将给药相应的靶向药物(almonertinib、dacomitinib、alectinib、crizotinib、vemurafenib、niraparib、pyrotinib、imatinib、palbociclib)。在本研究中,适应性设计被广泛采用,如样本量重新估计;自适应丰富;主协议自适应设计;多个自适应设计。我们相信平台研究可以通过跨肿瘤多药物同时筛查的模式,在很大程度上解决罕见肿瘤研究的问题,给这一人群带来好处。
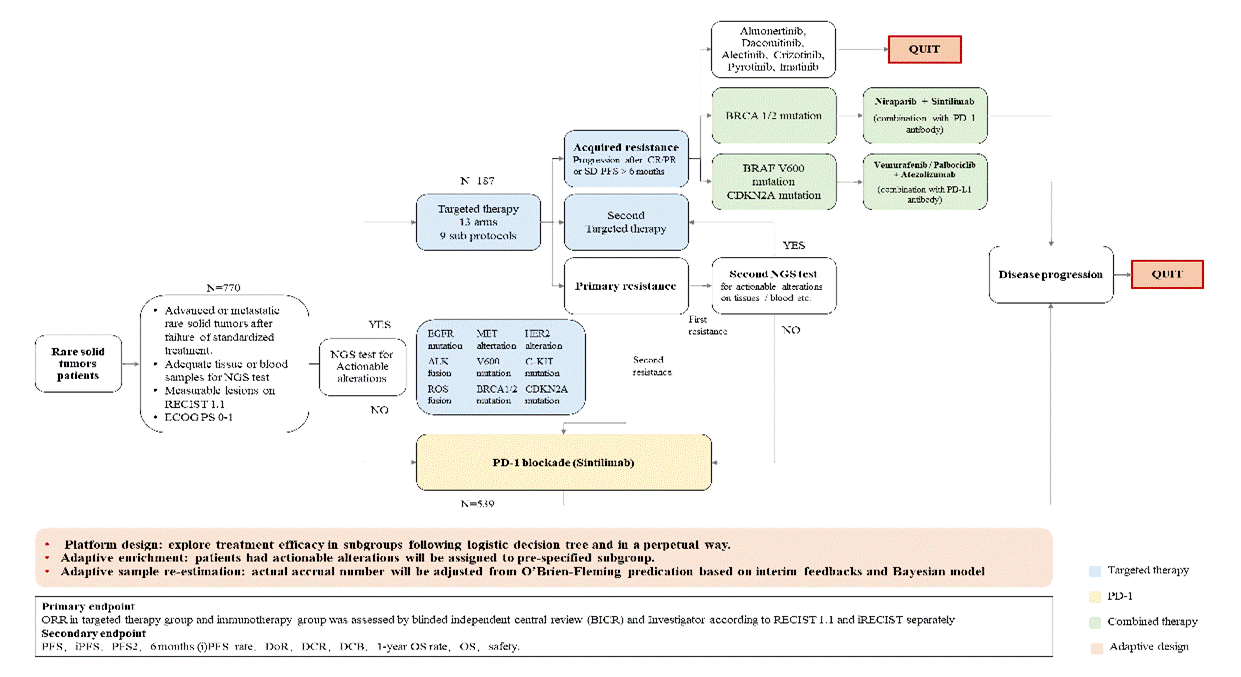
图5。我们正在进行的具有适应性设计的罕见实体肿瘤平台试验的图示
总之,从以往的成功和失败的经验表明,适应性设计是一种很有前途的新策略,以加速癌症治疗药物的开发,但有待更多的探索和标准化。适应性设计试验的实践可能是促进新药发现、促进药物从实验室向床上转化、加速新药商业化的有效途径。值得注意的是,自适应设计中的主方案有助于同时进行多组试验,包括多种试验药物和优化利用临床资源,在降低新药开发成本的同时提高效率。这可能是未来稀有癌症药物开发的重要策略之一。
本研究由中国医学科学院2019XK320068北京市科委资助(国际药物临床研究与开发平台2015)。中国医学科学院医学科学创新基金(临床试验能力平台提升2020-I2M-2-007)。北京市卫生健康委员会北京市示范区BCRW20200303。
作者声明没有利益冲突。
- Kairalla Ja,Coffey Cs,Thomann Ma,Muller Ke(2012)适应性试验设计:审查障碍和机遇。试验13:145。[Crossref]
- 自适应平台试验联盟(2019)自适应平台试验:定义、设计、实施和报告注意事项。Nat Rev Drug discovery18: 797 - 807。[Crossref]
- 伍德考克J, LaVange LM。掌握多种疗法、多种疾病或两者兼而有之的研究方案。n Engl J Med377: 62 - 70。[Crossref]
- Park JJ, Thorlund K, Mills EJ(2018)适应性临床试验中的关键概念。Clin eDemiol.10: 343 - 351。(Crossref)
- Müller HH, Schäfer H.临床试验的自适应组序贯设计:结合自适应和经典组序贯方法的优点。生物识别技术57: 886 - 891。[Crossref]
- 样本大小的重新估计:最近的发展和实际考虑。地中海统计20:2625-2643。[Crossref]
- Maca J,Bhattacharya S,Dragalin V(2006)自适应无缝阶段II / III去标志 - 背景,运营方面和示例。药物信息杂志40: 463 - 473。
- Simon N,Simon R(2013)适应性富集设计用于临床试验。生物统计学14:613-625。[Crossref]
- Chow SC(2014)适应性临床试验设计。地中海为基础65: 405 - 415。[Crossref]
- CHOW SC,Chang M(2008)临床试验中的自适应设计方法 - 综述。孤儿J罕见病3: 11。[Crossref]
- Harrington JA, Wheeler GM, Sweeting MJ, Mander AP, Jodrell DI(2013)双剂I期剂量增加研究的适应性设计。NAT Rev Clin incol10: 277 - 88。[Crossref]
- Rosenberger WF, Huc F(2004)在临床试验中最大限度地发挥作用,最大限度地减少治疗失败。中国新药临床试验1: 141 - 147。[Crossref]
- 张勇,陈明华,易建新,曾东,陈强,等。(2014)具有半竞争风险和治疗切换的生存数据的贝叶斯gamma脆弱模型。生命周期数据肛门20: 76 - 105。[Crossref]
- Pallmann P, bed AW, Choodari-Oskooei B, Dimairo M, Flight L, et al.(2018)临床试验中的适应性设计:为什么使用它们,如何运行和报告它们。BMC医学16:29。
- Li N, Huang HY, Wu DW, Yang ZM, Wang J, et al.(2019) 2009-18年间中国大陆肿瘤药物临床试验的变化:系统综述。《柳叶刀》杂志20: e619-e626。[Crossref]
- Kim ES, Herbst RS, Wistuba II, Lee JJ, Blumenschein GR Jr, et al. (2011) The BATTLE试验:肺癌的个性化治疗。癌症越是加大1: 44-53。[Crossref]
- 拉斯丹S,格柏德(2016)进入战斗:伞和篮子临床试验,以加速基于生物标志物的疗法研究。安Transl地中海4:529. [Crossref]
- Papadimitrakopoulou V, Lee JJ, Wistuba II, Tsao AS, Fossella FV,等。中华肿瘤防治杂志34: 3638 - 3647。[Crossref]
- Le Tourneau C, Delord JP, Gonçalves A, Gavoille C, Dubot C, et al.(2015)晚期癌症(SHIVA)的分子靶向治疗:一项多中心、开放标签、概念验证、随机、对照的2期试验。《柳叶刀》杂志16: 1324 - 1334。[Crossref]
- Ferrosoto R,Redman MW,Gandara Dr,Herbst Rs,Papadimitrakopoulou VA(2015)Lung-Map - 框架,概述和设计原则。Chin Clin oncol.4: 36。[Crossref]
- Herbst Rs,Gandara Dr,Hirsch Fr,雷德曼MW,Leblanc M等人。(2015)肺部总协议(肺部地图)-A生物标志驱动的协议,用于加速鳞状细胞肺癌疗法的发展:SWOG S1400。中国癌症Res21日:1514 - 1524。[Crossref]
- I-SPY2试验联盟,Yee D, DeMichele AM, Yau C, Isaacs C, et al.(2020) 2期和3期乳腺癌新辅助治疗中无事件和远处无复发生存与个体水平病理完全缓解的关系:I-SPY2自适应随机临床试验的3年随访分析。JAMA杂志6: 1355 - 1362。[Crossref]
- Nanda R, Liu MC, Yau C, Shatsky R, Pusztai L, et al. (2020) Pembrolizumab联合新辅助化疗对早期乳腺癌患者病理完全缓解的影响:正在进行的2期自适应随机I-SPY2试验的分析。JAMA杂志6:676-684。[Crossref]
- (2020)西妥昔单抗在无KRAS、NRAS或BRAF突变的乳腺癌、非小细胞肺癌和卵巢癌患者中的应用:靶向药物和图谱利用注册(TAPUR)研究的结果。目标杂志15: 733 - 741。[Crossref]
- 4 .王胜,黄浩,吴东,方辉,应军,等。(2017)基因分型指导下的罕见实体瘤精准医学平台研究:非随机、18个月、开放标签、多分支的II期zA研究方案。单中心临床试验,检测多种中国批准的靶向药物和PD-1抑制剂治疗转移性罕见肿瘤的安全性和有效性。BMJ开放11:E044543。[Crossref]










