目前关于2019冠状病毒病(COVID-19)发病机制的知识导致推测在严重急性呼吸综合征冠状病毒(SARS-CoV)-2感染中发生抗体依赖性增强(ADE),其机制由对SARS-CoV的假设推断:在之前接触过地方性冠状病毒的患者中,在病毒清除之前引发的一种强大的T辅助剂(Th)1依赖性中和抗体反应可能导致病毒细胞向性的改变。单核/巨噬细胞和B细胞的直接感染可确定疾病的免疫增强,其特征是巨噬细胞反应的倾斜和随后白细胞介素(IL)-6、IL-8和程序性死亡1配体的过度分泌,导致T细胞减少和衰竭,M1细胞在肺部积聚,导致严重和持续性肺损伤。ADE的发生不仅是为了评估候选疫苗的安全性,也是为了评估实验性免疫调节治疗的安全性和有效性:如果ADE发生,羟基(氯喹)可能通过增强B细胞内的SARS-CoV-2,抑制肺部巨噬细胞M2极化,从而加重COVID-19病例的严重程度。相反,乌司他丁可有效逆转巨噬细胞反应的倾斜,胸腺素α1 (Tα1)可逆转T细胞减少和衰竭,促进Th2细胞分化。1型/ 2型免疫反应失调可能是几种病毒感染(如登革出血热、埃博拉病毒感染和其他病毒性出血热)发生ADE的一种致病机制。因此,Tα1和乌司他丁联合应用不仅可用于治疗重症COVID-19患者,还可用于治疗其他已证实或假设存在ADE感染的致命病毒性疾病。
抗体依赖性增强(ADE)、COVID-19、羟氯喹、SARS-CoV-2、胸腺素α 1、1/ 2型免疫反应、乌司他提
2019冠状病毒病(COVID-19)是由严重急性呼吸综合征冠状病毒(SARS- CoV)-2感染引起的,具有广泛的临床症状,从无症状-轻度到致命病例[1]。疾病严重程度可归因于异常的宿主反应[2],类似于SARS- CoV感染[3]的病理生理学。正如先前对SARS患者的假设一样,SARS- cov -2感染中抗体依赖性增强(ADE)的发生被认为是临床表现和地理致死率差异的可能解释[4,5]。
感染的ADE被广泛的病毒利用,被认为发生在病毒被非中和抗体或亚中和浓度的抗体结合时,这些抗体不是中和它,而是促进病毒内化到宿主细胞(外源性ADE)[6]。内化抗体-病毒免疫复合物可调节先天抗病毒反应,增加病毒产生(固有ADE)[6]。ADE现象被认为促使炎症和血管活性介质的大量释放,最终导致疾病的严重程度[6]。外源性ADE主要由可结晶的片段γ受体(Fcγ r)表达细胞介导,该细胞结合原发感染期间产生的循环免疫球蛋白(Ig)G抗体的Fc部分,因此它需要对特异性病毒表位[6]的体液免疫反应提前致敏。然而,在西尼罗病毒感染中,首次描述了一种独立于IgG的ADE机制:感染的增强与补体受体和IgM抗体之间的相互作用有关;与IgG和igm相关的两种增强途径相互独立但不相互排斥,[7]可协同作用。同样在埃博拉病毒感染中,两种途径都在体外被描述过:IgM水平与补体成分1q (C1q)/C1q受体依赖的ADE相关,而IgG2a水平与fc γ r依赖的机制相关。有趣的是,当IgG2a抗体触发ADE时,IgG1抗体发挥了中和作用:因此,只有对T辅助性(Th)1表型的反应与ADE[8]相关。
对于许多病毒来说,ADE通过感染更多的易感细胞[9]来增加病毒载量,而SARS-CoV感染的ADE的特征是细胞趋向的改变:抗刺突蛋白IgG抗体(S-IgG)中和病毒进入承载血管紧张素转换酶2 (ACE2)的细胞(靶细胞),并通过IgG/ fc γ rii依赖性增强病毒内化到巨噬细胞、单核细胞和B细胞,ace2独立机制[10-14](图1)。并非所有承载FcγRII的细胞都允许SARS-CoV感染ADE,这似乎依赖于细胞内FcγRII结构域和下游信号,而不是细胞外结合亲和力或免疫复合物内化率[14]。免疫细胞的感染似乎是自我限制的或流产的[10-13],然而,考虑到细胞内固有免疫传感器能够检测病毒基因种类和SARS-CoV蛋白引起的细胞稳态紊乱,B细胞在ADE的致病机制中起着中心作用[11,12]。虽然初步研究发现感染巨噬细胞[13]的促炎细胞因子/趋化因子基因表达没有变化,但最近的一项研究明确了巨噬细胞极化在SARS-CoV发病机制[15]ADE中的作用。在对各种信号的响应中,巨噬细胞可能经历toll样受体(TLR)配体和干扰素-γ (IFN-γ)-刺激的经典M1激活或白介素(IL)-4/IL-13-刺激的替代M2激活,镜像T细胞[16]的Th1-Th2极化。极化M1-M2巨噬细胞的表型可以逆转:经典激活的M1细胞参与启动和维持炎症,而M2或M2样细胞与分解过程[17]有关。Liu和同事使用sars - cov猕猴模型显示,尽管病毒抑制,S-IgG预处理组与对照组相比,肺损伤明显增强和持续:在未接受S-IgG治疗的猕猴中,肺泡单核/巨噬细胞早在感染后2天就具有M2功能,导致肺损伤的缓解和内稳态的恢复,相反,S-IgG治疗扭曲了肺中的巨噬细胞反应,导致促炎M1细胞持续存在,炎症失控和组织损伤[15]。作者在感染的第一周对生产性病毒感染、抗体反应和巨噬细胞功能变化进行了时间分析,观察到只有当中和抗体(NAb)反应在病毒清除[15]之前已被激发时,才会出现向M1细胞的倾斜。 Histopathological examination of deceased SARS patients showed findings similar to those found in ADE-SARS-CoV macaques, with pro-inflammatory M1 lung infiltration and absence of M2 cells [15]. S-IgG sera had no effect on M1 cells of deceased patients, but caused a dose-dependent increase in the production of IL-8, IL-6 and monocyte chemo-attractant protein 1 (MCP1) in M2 cells [15]. Similar results were observed when treating M2 cells of SARS patients, obtained during the acute phase of the infection, with antisera from deceased SARS patients: IL-8 production was correlates with the NAb titers of sera [15]. Interestingly, all but one antisera from recovered SARS patients did not elicit cytokine overproduction in M2 cells, the only M2 skewing sera had higher NAb titer (similar to those found in deceased patients) compared to the others [15]. These latter findings are consistent with the observation that an early NAb response (and a concomitant robust Th1 response) is a marker of poor disease outcome in SARS patients [18,19], while clinically mild cases have relatively low antibody titers and a less sustained immune response [20,21]. Taking into account serological cross-reaction between SARS-CoV and human endemic coronaviruses (HCoVs), the priming effect of a previous HCoV infection could be responsible for an early IgG response in severe cases of SARS [18]. In conclusion, the occurrence of ADE in SARS-CoV infection seems to depend on a previous exposure to HCoVs, responsible for an early sero-conversion, and on a concomitant robust Th1 response. The phenomenon could lead to a change in SARS-CoV cell tropism with direct infection of monocytes/macrophages and B cells, through an ACE2-indipendent mechanism, and consequently to an immune enhancement of the disease which causes the inhibition of the M2 cells activation and the accumulation of M1 cells in the lungs, responsible for severe and persistent lung injury.
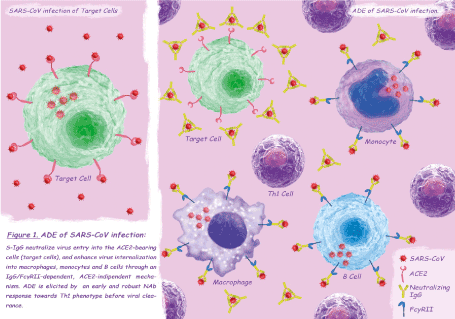
图1所示。sars冠状病毒感染的ADE
SARS-CoV2感染的ADE
SARS- cov -2感染的病理生理似乎与SARS- cov感染密切相关:死亡患者病理检查显示肺内肺泡间隙和纤维增生区巨噬细胞聚集,疾病分期与SARS早期渗出性弥漫性肺泡损伤(渗出性弥漫性肺泡损伤,DAD)、晚期有组织和纤维化的DAD相似[2,22,23]。严重者表现为促炎细胞因子和淋巴细胞减少症的大量释放,特别是血清中IL-6和IL-8的升高与疾病[2]的进展和T淋巴细胞减少症[22]的扩展有关。淋巴细胞减少症与T细胞表面程序性细胞死亡蛋白-1 (PD-1)的表达直接相关,PD-1是T细胞衰竭的标志[24,25]。有趣的是,T细胞衰竭和疾病严重程度之间的相关性也在埃博拉病毒感染[26]中得到了证实。COVID-19死亡患者的肺泡巨噬细胞广泛且强烈表达PD-1配体(PD-L1)[22],因此肺部炎症可触发PD-1/PD-L1轴,导致T细胞衰竭。PD-L1的强烈上调是典型M1激活[27]的间接标志,因此,与ade -SARS-猴模型类似,在SARS- CoV-2感染中,M2反应的抑制和M1细胞的积累可能是严重肺损伤的原因(图2)。正如之前对SARS- cov感染的描述,在COVID-19患者中,巨噬细胞可能直接受病毒影响[2,22]。B细胞似乎在严重病例[28]的发病机制中起着至关重要的作用。
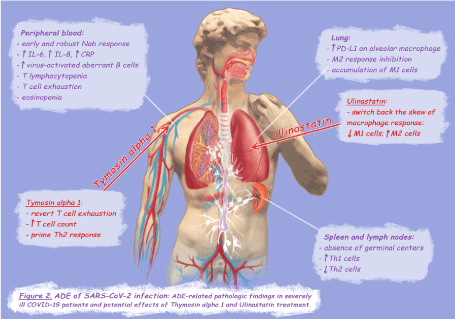
图2。新型冠状病毒感染的ADE
一项关于COVID-19重症患者对SARS-Cov-2感染的适应性免疫反应的有趣研究显示,通过分析死亡患者的淋巴结和脾脏,生发中心的缺失,Th1细胞大幅增加,而Th2细胞[29]持续减少。此外,检测到一种生发外中心/滤泡外类型的对SARS-CoV-2的类切换抗体反应,其中在重症患者的组织和血液中大量积累病毒激活的异常B细胞-包括切换记忆B细胞-[29](图2)。这可以解释为什么在一些COVID-19患者中观察到IgG比IgM更早出现,这表明对交叉反应抗原[31]的二次免疫反应。因此,从SARS- Cov-2感染中康复的老年患者的NAb滴度明显高于年轻患者[32]的原因可能是与年轻受试者相比,他们之前接触hcov感染的次数更多。在从轻度COVID-19康复的患者中,出院时NAb滴度与血液CRP水平呈正相关,但与入院时淋巴细胞计数呈负相关,这表明NAb水平高可能与强烈的炎症[32]有关。有证据证实了这一假设,在进入重症监护病房(ICU)的患者中,NAb反应明显比轻症患者[33]上升得更早和更大。
在SARS-CoV和埃博拉病毒感染中,之前接触交叉反应抗原似乎是发生ADE的必要条件,但不是充分条件:事实上,只有对Th1表型的强抗体反应似乎与疾病的增强有关[8,18,19]。值得注意的是,肥胖、2型糖尿病和高血压是严重COVID-19的危险因素[34,35],它们都是以免疫细胞慢性1型极化为特征的临床条件[36-38],相反,过敏史(一种th2偏偏的免疫反应条件)似乎可以防止临床严重感染[39,40]。此外,嗜酸性粒细胞减少被认为是临床预后不良的标志,而血清嗜酸性粒细胞增加已被认为是临床改善的指标[42]。所有上述证据导致推测在SARS-CoV-2感染中发生ADE的机制,这些机制由那些对SARS-CoV的假设推断:在之前接触过hcov的COVID-19患者中,在病毒清除之前引发的针对Th1表型的早期和强大的NAb反应可能导致病毒细胞趋性的改变。直接感染单核/巨噬细胞和B细胞可以确定疾病的免疫增强,其特征是抑制M2反应,随后过度分泌IL-6、IL-8和PD-L1,导致T细胞减少和衰竭,M1细胞在肺部积聚和持续(图2)。
羟氯喹
不仅要评估候选疫苗[43]的安全性,而且要评估研究性免疫调节治疗的安全性和有效性,应考虑SARS-CoV-2感染中ADE的发生。其中,4-氨基喹啉氯喹(CQ)和羟基氯喹(HCQ)因其所谓的抗病毒和抗炎作用而被广泛使用。
一项多中心、随机、对照试验的初步结果显示,在住院的COVID-19患者中,羟氯喹的使用与较长的住院时间和进展到有创机械通气或死亡[44]的风险增加有关。特别值得注意的是药物引起的QTc间隔延长和室性心律失常,这似乎高于使用4-氨基喹啉[45]治疗的COVID-19患者的预期;然而,除了药物诱导的心脏毒性外,有人假设它们可能通过其他机制加重COVID-19的严重程度[46,47]。CQ的抗病毒功效已通过对SARS-CoV感染的体外实验得到证实:研究表明,增加内体pH值和改变ACE2糖基化可以阻止病毒进入[48],但虽然增加的内体pH值抑制病毒进入靶细胞,但它增强了SARS-CoV在B细胞中的内化,这是一种不依赖于ACE2的机制[12]。关于抗疟化合物的免疫调节作用,CQ通过两种方式抑制M2极化:第一,它通过减少IL-2的产生和IL-2的响应性来抑制T细胞增殖,IL-2在Th2细胞分化[47]的“启动”T细胞中起着至关重要的作用;其次,通过中和溶酶体ph值,抑制巨噬细胞溶酶体脂解,这是il -4依赖性M2激活通路[49]的一个基本过程。因此,如果ADE发生在重症COVID-19患者中,CQ和HCQ可能通过进一步增强ADE的相同致病机制而使临床病程恶化。QTc间隔延长和室性心律失常的高百分比可能不仅仅是4-氨基喹啉的直接药物副作用,而是可能代表由治疗引起的疾病免疫增强继发的心肌损伤的迹象。有趣的是,在使用HCQ[50]治疗的轻症COVID-19病例中没有心脏副作用的报道,而Th1/Th2反应失衡已被提出作为严重SARS-CoV-2感染[51]心肌损伤的机制。总之,虽然抗疟药物给药效率低,但可能不会对轻症患者[50]产生不良后果,但它似乎对严重的COVID-19患者[44]产生不利影响,这些患者很可能发生ADE。
胸腺素α1
一项小型观察性研究表明,给予胸腺素α1 (Tα1)可通过恢复T细胞数量和降低T细胞表面[25]上PD-1的表达,显著降低COVID-19重症患者的死亡率。尽管胸腺肽Tα1对免疫系统具有多效性,T细胞增殖和预防T细胞衰竭似乎与增加IL-2的产生和IL-2响应性[52]有关:与CQ对T细胞的作用相反。有趣的是,Tα1治疗败血症患者显示出对死亡率的有利影响,恢复外周血T细胞计数,平衡促炎和抗炎细胞因子,降低血清肿瘤坏死因子- α (TNF- α)水平,增加IL-10[53]。事实上,在败血症中,不平衡的促炎反应似乎是导致组织/器官损伤的原因,与在COVID-19患者中观察到的情况类似,过敏史似乎是一个保护因素[54]。Krishack和他的同事评估了Th细胞的极化金黄色葡萄球菌菌血症,显示存活者在感染[54]的早期有更高的循环Th2细胞百分比。作者利用动物模型阐明了2型免疫反应和随后的嗜酸性粒细胞增多在平衡病原体诱导的促炎反应[54]方面的保护作用。引用的研究中其他有趣的发现是,败血症相关的死亡率可能是由肺部的炎症反应引起的,炎症的驱动因素似乎是宿主反应本身固有的,而不是与细菌[54]的持久性有关。
乌司他丁
当与乌司他丁联合使用时,Tα1对脓毒症患者的免疫平衡作用似乎增强了[55,56]。乌司他丁是从男性尿液中分离纯化得到的一种尿胰蛋白酶抑制剂,可抑制炎症因子的产生和炎症介质的释放,改善炎症微环境[57]的失衡。Zhang等人在一项针对碳青霉烯耐药细菌引起的腹腔内感染引起的败血症的小型随机临床试验(RCT)中表明,联合应用Tα1和乌司他汀可提高生存率,并与更短的机械通气时间、更短的多巴胺治疗时间和更短的ICU住院时间相关:第8天,与对照组相比,治疗组的T细胞数量更多,IL-4和IL-10水平更高,而TNF-α、IL-1和IL-6水平更低。Liu等通过实验小鼠模型研究了免疫抑制下乌司他丁对严重肺部感染的保护作用:模型组出现肺泡水肿和巨噬细胞浸润的严重肺损伤,而乌司他丁组大部分肺组织保持完整[57]。模型组支气管肺泡灌洗液中IL-6、TNF-α、IL-1β水平明显升高,IL-4、IL-10、IL-13水平明显降低,治疗组促炎、抗炎细胞因子水平恢复正常[57]水平。最后,通过对比肺内巨噬细胞极化,模型组M1细胞浓度明显高于乌司他汀组,M2细胞数量明显低于乌司他汀组:作者认为乌司他汀可能通过M1向M2巨噬细胞极化调节炎症微环境,对免疫抑制小鼠肺损伤产生保护作用。由于其免疫调节特性,尿胰蛋白酶抑制剂已被提议作为COVID-19治疗[58]的潜在候选药物,但尚未开展关于其疗效的研究。
综上所述,乌司他丁可有效逆转ADE-SARS-CoV-2患者巨噬细胞反应的倾斜,而Tα1可恢复T细胞计数,恢复T细胞衰竭,促进Th2细胞分化(图2)。
其他病毒感染ADE的免疫失衡
有趣的是,促炎细胞因子IL-6、IL-8和抗炎细胞因子IL-10之间的失衡似乎与登革热患者的出血性表现[59]有关;因此,1型/ 2型免疫反应失调可能是几种病毒感染发生ADE的一种致病机制。因此,考虑到缺乏特定的治疗方法和疫苗,Tα1和乌司他丁的联合应用不仅可以用于高致病性的人类冠状病毒,还可以用于其他已经证实或假设有ADE感染的致命病毒性疾病,如美国登革出血热、埃博拉病毒感染和其他病毒性出血热。
总之,需要进一步研究SARS-CoV-2感染中ADE的发生,不仅是为了评估候选疫苗的安全性,也是为了寻找有效的免疫调节治疗方法。鉴于这两种化合物的已知安全性[55,56,58],以及在COVID-19病例中感染ADE的潜在发生,需要进行大型rct来评估Tα1和乌司他丁治疗COVID-19重症患者的疗效。这两种药物的有效性也可以在其他致命性病毒性疾病中进行研究,这些疾病的ADE感染已经得到证实或假设。
本研究或这篇文章的发表没有收到任何资助或赞助。
Maurizio Guastalegname, Laura D 'argenio和Alfredo Vallone符合本文作者国际医学期刊编辑委员会(ICMJE)的标准,对整个工作的完整性负责,并已批准本版本发表。
Maurizio Guastalegname, Laura D 'argenio和Alfredo Vallone声明他们没有利益冲突。
- 张宏,尚伟,刘强,张旭,郑明等。(2020)黄冈、泰安地区194例新型冠状病毒感染的临床特征。感染1 - 8。(Crossref)
- 李松,姜林,李旭(2020)新型冠状病毒肺炎重症患者的临床和病理调查。江森自控的洞察力5: 138070。(Crossref)
- Petrosillo N, Viceconte G, Ergonul O, Ippolito G, Petersen E等人(2020年)COVID-19、SARS和MERS:它们是否密切相关?中国Microbiol感染26日:729 - 734。(Crossref)
- teteo JA (2020) COVID-19是否从其他冠状病毒获得ADE ?微生物感染22日:72 - 73。(Crossref)
- Cegolon L, Pichierri J, Mastrangelo G(2020)解释意大利北部COVID-19严重形式的假说。BMJ水珠健康5: e002564。
- Taylor A, Foo SS, Bruzzone R, Dinh LV, King NJ等(2015)病毒感染抗体依赖性增强中的Fc受体。Immunol牧师268: 340 - 364。
- Cardosa MJ, Porterfield JS, Gordon S(1983)补体受体介导巨噬细胞中黄病毒复制增强。J Exp地中海158: 258 - 263。
- 高田A, Ebihara H, Feldmann H, Geisbert TW, Kawaoka Y,等(2007)埃博拉病毒感染抗体依赖性增强所需的表位。J感染说196备用2:S347-S356。(Crossref)
- 抗体介导的病毒性疾病增强。Curr Top微生物免疫260: 145 - 169。
- 李丽,Wo J,邵娟(2003)SARS冠状病毒在SARS患者外周血单个核细胞中的复制.中国性28日:239 - 244。(Crossref)
- Kam YW, Kien F, Roberts A(2007)抗三聚体S糖蛋白抗体保护仓鼠对抗SARS-CoV挑战,尽管它们有能力介导体外的fcgammarii依赖性进入B细胞。疫苗25日:729 - 740。
- Jaume M, Yip MS,张CY(2011)抗严重急性呼吸综合征冠状病毒刺突抗体通过pH-和半胱氨酸蛋白酶独立的FcγR途径引发人类免疫细胞感染。J性研究85: 10582 - 10597。
- 叶淑娟,梁海林,李福生(2016)SARS冠状病毒感染抗体依赖性增强及其在SARS发病中的作用。香港医学院22: 25-31。(Crossref)
- 叶淑娟,梁乃华,刘志强(2014)严重急性呼吸综合征冠状病毒抗体依赖性人巨噬细胞感染。性研究J11: 82。
- 刘丽,魏强,林强(2019)抗刺突IgG通过扭曲巨噬细胞反应在急性SARS-CoV感染中引起严重急性肺损伤。江森自控的洞察力4: e123158。
- Sica A, Mantovani A(2012)巨噬细胞的可塑性和极化:在体内真实。中国投资122: 787 - 795。
- Martinez FO, Helming L, Gordon S(2009)巨噬细胞的替代激活:免疫功能的视角。为Immunol27日:451 - 483。
- 何淑娟,陈文杰,陈海燕(2005)中和抗体反应与SARS严重程度。紧急情况感染说11: 1730 - 1737。
- 李宁,陈pk,叶明(2006)sars冠状病毒IgG抗体与严重急性呼吸综合征疾病严重程度的关系。中国性35: 179 - 184。
- 曹永英,曾浩特,林斌,吴志强,林伟,等(2004)感染后严重急性呼吸综合征相关冠状病毒免疫球蛋白的自然过程。J感染说190: 1706 - 1707。
- Wilder-Smith A, Teleman MD, Heng BH, Earnest A, Ling AE,等(2005)新加坡医护人员无症状SARS冠状病毒感染。紧急情况感染说11: 1142 - 1145。
- 王C,赵谢J L(2020)肺泡巨噬细胞功能障碍的发病机理和细胞因子风暴两个严重COVID-19病人。EBioMedicine57: 102833。
- Nunes Duarte-Neto A, de Almeida Monteiro RA, Da Silva LFF(2020年)通过超声引导的微创尸检评估COVID-19的肺部和全身受累情况。组织病理学77: 186 - 197。(Crossref)
- 刁斌,王超,谭勇(2020)2019冠状病毒病(COVID-19)患者T细胞减少和功能衰竭。前面Immunol11: 827。(Crossref)
- 刘颖,庞颖,胡铮(2020)胸腺素α1 (Tα1)通过恢复淋巴细胞减少症和逆转衰竭T细胞降低重症COVID-19的死亡率。中国感染说71: 2150 - 2157。(Crossref)
- Ruibal P, Oestereich L, Lüdtke A(2016)几内亚埃博拉病毒疾病独特的人类免疫特征。自然533: 100 - 104。(Crossref)
- Loke P, Allison JP (2003) PD-L1和PD-L2受Th1和Th2细胞的差异调控。美国国家科学研究院100: 5336 - 5341。(Crossref)
- B细胞在COVID-19中的可能作用?阿氨球蛋白血症患者的教训。过敏临床免疫学杂志146: 211 - 213. - e4。(Crossref)
- Kaneko N, Kuo HH, Boucau J (2020) Massachusetts Consortium on病原体准备标本工作组。COVID-19中表达bcl -6的T滤泡辅助细胞和生发中心的丢失细胞183: 143 - 157. - e13。
- Van der Heide V(2020)健康捐献者中的SARS-CoV-2交叉反应。Nat Immunol牧师20: 408。(Crossref)
- Fierz W, Walz B(2020)原始抗原原素导致的抗体依赖性增强与SARS的发展。前面Immunol11: 1120。(Crossref)
- 吴峰,刘敏,王安(2020)评估上海轻度COVID-19康复患者临床特征与中和抗体水平的相关性。JAMA实习生地中海180: 1356 - 1362。(Crossref)
- 刘丽,杜克克,陈克勤(2020)COVID-19重症监护病房患者的高中和抗体滴度。紧急情况微生物感染8:行。
- Denova-Gutiérrez E, Lopez-Gatell H, Alomia-Zegarra JL(2020)墨西哥人入院时严重COVID-19与肥胖、2型糖尿病和高血压之间的关系。肥胖(银泉)。(Crossref)
- 陈强,郑智,张超(2020)浙江台州145例新型冠状病毒病(COVID-19)患者的临床特征。感染48: 543 - 551。(Crossref)
- 吴浩,Ballantyne CM。肥胖中的代谢性炎症和胰岛素抵抗。中国保监会Res126: 1549 - 1564。
- 周涛,胡铮,杨松,孙林,于铮等(2018)适应免疫和先天免疫在2型糖尿病中的作用。J糖尿病Res2018: 7457269。
- Idris-Khodja N, MO Mian P, Paradis P, Schiffrin EL(2014)适应性免疫在高血压中的双重对立作用。EurHeart J35: 1238 - 1244。(Crossref)
- 石伟,高震,丁勇,朱涛,张伟,等。(2020)新冠肺炎合并过敏患者的临床特征。过敏75: 2405 - 2408。(Crossref)
- 刘胜,支勇,应生(2020)COVID-19与哮喘:大流行期间的反思。临床Rev过敏免疫59: 78 - 88(Crossref)
- 秦晨,周磊,胡铮(2020)武汉地区新冠肺炎患者免疫反应失调。中国感染说71: 762 - 768。(Crossref)
- 刘峰,徐安,张勇(2020)COVID-19患者可能受益于洛匹那韦联合持续方案,嗜酸性粒细胞增加可能预测COVID-19进展的结局。感染疾病95: 183 - 191。
- Arvin AM, Fink K, Schmid MA (2020) SARS-CoV-2抗体依赖性增强的可能性。自然.(Crossref)
- Horby P, Mafham M, Linsell L(2020)羟氯喹对COVID-19住院患者的影响:一项多中心、随机、对照试验的初步结果。medRxiv383: 2030 - 2040
- Jankelson L, Karam G, Becker ML, Chinitz LA, Tsai MC等人(2020)使用氯喹或羟氯喹短疗程治疗COVID-19的QT延长、点扭转和猝死:一项系统综述。心脏的节奏s1547 - 5271: 30431 - 30438。
- Touret F, de Lamballerie X(2020年)氯喹和COVID-19。抗病毒Res177: 104762。
- Guastalegname M, Vallone A(2020)氯喹/羟基氯喹在2019冠状病毒病(COVID-19)的治疗中是否有害?中国感染说71: 888 - 889。(Crossref)
- Vincent MJ, Bergeron E, Benjannet S(2005)氯喹是SARS冠状病毒感染和传播的有效抑制剂.性研究J2: 69。
- 黄SC, Everts B, Ivanova Y(2014)细胞内溶酶体脂解是巨噬细胞替代激活的必要条件。Nat Immunol15: 846 - 855。
- Mitjà O, Corbacho-Monné M, Ubals M(2020)羟氯喹用于轻度Covid-19成人早期治疗:一项随机对照试验。中国感染说.ciaa1009。(Crossref)
- 郑媛媛,马依桐,张建勇,谢曦(2020)新冠肺炎与心血管系统。Nat牧师心功能杂志17: 259 - 260。
- Baxevanis CN, Frillingos S, Seferiadis K(1990)原胸腺素增强人T淋巴细胞功能:增加正常人外周血T淋巴细胞中白细胞介素-2的产生和白细胞介素-2受体的表达。Immunopharmacol Immunotoxicol12: 595 - 617。
- 刘芳,王红梅,王涛,张艳梅,朱霞等(2016)胸腺素α1作为败血症免疫调节治疗的疗效:随机对照试验的系统综述。BMC感染说16: 488。
- Krishack PA, Louviere TJ, Decker TS(2019)预防金黄色葡萄球菌菌血症引起的死亡取决于ilc2和嗜酸性粒细胞。江森自控的洞察力4: e124168。(Crossref)
- 陈宏,何明明,李玉梅(2009)乌司他丁联合胸腺素α 1治疗严重脓毒症的前瞻性、随机、对照先导研究。中华医学杂志(英文版)22:883-888。(Crossref)
- 张莹,陈红,李艳梅(2008)胸腺素α 1和乌司他丁为基础的免疫调节策略对碳青霉烯类耐药菌腹腔感染败血症的影响。J感染说198: 723 - 730。(Crossref)
- 刘伟,庞刚,王松,孙安(2017)乌司他丁对免疫抑制下重症肺部感染的保护作用及其分子机制。Exp其他地中海14: 3583 - 3588。
- 叶强,王斌,毛娟(2020)新冠肺炎“细胞因子风暴”的发病机制及治疗。J感染80: 607 - 613。
- Iani FC, Caldas S, Duarte MM(2016)早期出血表现的登革热患者失去了抗炎细胞因子il-10与炎症细胞因子IL-6和IL-8的协调表达。Am J Trop Med Hyg95: 193 - 200。(Crossref)



